题目内容
【题目】实验室需要4.48L(标准状况下)H2,现用金属锌与足量的稀盐酸反应,问:
(1)至少需要金属锌多少克?
(2)生成氯化锌的物质的量是多少?
【答案】13g;0.2mol
【解析】(1)氢气的物质的量是4.48L÷22.4L/mol=0.2mol,根据方程式可知
Zn+2HCl=ZnCl2+H2↑
1mol 1mol 1mol
0.2mol 0.2mol 0.2mol
所以至少需要金属锌的质量是0.2mol×65g/mol=13.0g。
(2)根据以上分析可知生成的氯化锌的物质的量是0.2mol。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) ΔH= -612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) ΔH= -798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为__________________________________
(2)不同温度下反应CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH的平衡常数如下表所示。
CO2(g) + H2(g) ΔH的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)= 0.005mol/L、c(H2)= 0.015mol/L,则CO的平衡转化率为______。
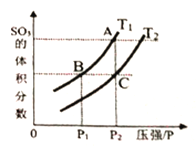
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是__________
A. SO2和SO3浓度相等 B. 容器中混合气体的密度保持不变
C. 容器中气体的压强保持不变 D. SO3的生成速率与SO2的生成速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1______T2 (填“>”或“<");如果想加快正反应的速率,除了改变温度,还可以用___________方法。