��Ŀ����
����Ŀ����������(CaO2)������ʳƷ�����ۡ���ױƷ�����Ӽ���Ҳ���������ӵ�����������֪����Һ���Ʊ��Ĺ������ƴ���8���ᾧˮ����100��ʱ����ˮ������ɫ����ˮ�������ƣ�����ˮ����������350��ʱ��Ѹ�ٷֽ�����CaO��O2���ش�����������
��CaO2�к��еĻ�ѧ��������________________��
(2)ʵ�����ô�����CaCO3��H2O2��ȡ�������Ƶ�ʵ�鲽��������

���ձ�A�з�����Ӧ�����ӷ���ʽΪ_____________________ ��
�ڹ���ʱ�õ��IJ����������ձ��⣬����______________________��
���ñ�ˮ��ȴ�ձ�C��Ŀ����___________________��
(3)Ϊ�ⶨ��Ʒ��CaO2������������ȡm g��Ʒ�����¶ȸ���350��ʱʹ֮��ַֽ⣬��������������(�ָ�����״��)ͨ����ͼ��ʾװ�����ռ���ˮ�����ΪV mL�����ƷCaO2����������Ϊ__________(�г�����ʽ����)��

���𰸡� ���Ӽ��ͷǼ��Լ�(�����Ӽ����ۼ�) CaCO3+2H+=Ca2++CO2��+H2O ©���Ͳ����� ��ֹH2O2�ֽ��Ũ��ˮ�ӷ� ��
����������1��CaO2��Ca2����O22�D֮���γ����Ӽ���O22�D��������ԭ�Ӽ��γɷǼ��Լ�(�����Ӽ����ۼ�) ����2�����ձ�A���Ʊ�CO2�����ӷ���ʽΪCaCO3+2H+=Ca2++CO2��+H2O���ڹ���ʱ�õ��IJ����������ձ��⣬���� ©���Ͳ����������ñ�ˮ��ȴ�ձ�C��Ŀ���Ƿ�ֹH2O2�ֽ��Ũ��ˮ�ӷ�����5���������������Ϊx��
2CaO2 ![]() 2CaO + O2��
2CaO + O2��
144g 22.4L
x 10-3VL
144g��22.4L=x��10-3VL
x=![]()
����������=![]()

 ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�����Ŀ����Һ©����֪��R��OH+HX��R��X+H2O
��ͼ��ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ�Ʊ��������װ�ã�ͼ��ʡȥ�˼���װ�ã��й����ݼ�����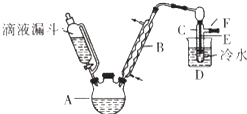
�Ҵ��������顢���йز���
�Ҵ� | ������ | �� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | �����ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 1.44 | 3.1 |
�е�/�� | 78.5 | 38.4 | 59 |
��1���Ʊ������У������Ũ����������ϡ�ͣ���Ŀ���� ��
a���ٸ�����ϩ���ѵ����� b������Br2������c����HBr�Ļӷ� d��ˮ�Ƿ�Ӧ�Ĵ���
��2�����ȵ�Ŀ�����������ʺ���������ش𣩣�Ӧ��ȡ�ļ��ȷ�ʽ�� ��
��3��Ϊ��ȥ��Ʒ�е�һ����Ҫ���ʣ����ѡ��������Һ��ϴ�Ӳ�Ʒ��
A.��������
B.�⻯��
C.��������
��4���ڣ�3������ʵ������Ҫ����Ҫ���������� ��
����Ŀ�����㷺�����������ʡ�������ȷ��档�ش�����������
(1)ʵ���ҿ�����ͼ��ʾװ�úϳɰ���
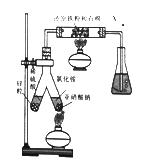
�ٺϳɰ�ʱ����ԭ���۵�������________________��
����ƿ��ʢ��һ������ˮ�������м��η�̪�Լ�����Ӧ����ʱ�������ƿ����Һ�����������X�ijɷ�ΪN2��ˮ������____________��_________________��
�����˹̹����ѧ�о���Ա������һ��SUNCAT���ѭ��ϵͳ���ɳ����ϳɰ�����ԭ����ͼ��ʾ��
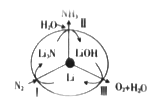
��ͼ�з�Ӧ���Ļ�ѧ����ʽΪ____________________��
�ڷ�Ӧ��������ת���ķ�ʽ��__________________(�����ת��Ϊ��ѧ�ܡ���ѧ��ת��Ϊ���ܡ�)��
(3)Һ���������������Һ������ʱ__________(��ͷ��������ա�)������Һ��й©������ᷢ����ը����֪���ֻ�ѧ���ļ����������±���ʾ��
���ۼ� | N-H | O=O | N��N | O-H |
����/kJ��mol-1 | 391 | 498 | 946 | 463 |
��Ӧ 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)�ķ�Ӧ����H=____________��
