题目内容
12.写出下列微粒的电子式:氮气
 Na2S
Na2S
NaOH
 CO2
CO2 .
.
分析 氮气分子中两个氮原子共用3对电子;
Na2S为离子化合物,钠离子用离子符号表示,硫离子需标出最外层电子;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,据此书写即可.
解答 解:氮气分子中两个氮原子共用3对电子,电子式为: ;
;
Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ;
;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ;
;
CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ;故答案为:
;故答案为: ;
; ;
; ;
; .
.
点评 本题考查了电子式、结构式的书写,题目难度中等,试题题量较大,充分考查了学生对书写知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.材料是人类赖以生存的重要物质基础.下列有关材料的说法正确的是( )
| A. | 玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都是石灰石 | |
| B. | 钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 | |
| C. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| D. | 铝制品在空气中不易被腐蚀,是因为常温下铝不与氧气反应 |
3.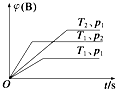 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H>0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |
7.一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g),能说明该反应达到化学平衡状态的是( )
| A. | 生成NH3的物质的量与消耗NH3的物质的量相等 | |
| B. | 消耗1molN2,同时消耗3molH2 | |
| C. | N2、H2、NH3在密闭容器中共存 | |
| D. | 正、逆反应速率都等于0 |
4.下列说法不正确的是( )
| A. | 同温下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大 | |
| B. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多 | |
| C. | 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 | |
| D. | 除去溶液中的Mg2+,用OH-比CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小 |
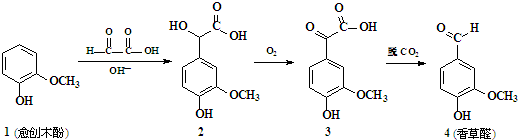
1.香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如图所示.下列说法正确的是( )【提示 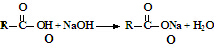 】
】
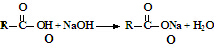 】
】
| A. | 1→2、2→3的转化分别为取代反应和消去反应 | |
| B. | 化合物2在一定条件下可发生加聚反应 | |
| C. | 可用FeCl3溶液检验制得的香草醛中是否混有化合物3 | |
| D. | 等物质的量的四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:2:2:1 |
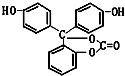 如图所示下列物质最多与5molNaOH反应,最多与4molBr2反应,最多与9molH2反应.它的分子式为C20H14O5.
如图所示下列物质最多与5molNaOH反应,最多与4molBr2反应,最多与9molH2反应.它的分子式为C20H14O5.