题目内容
17.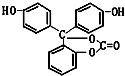 如图所示下列物质最多与5molNaOH反应,最多与4molBr2反应,最多与9molH2反应.它的分子式为C20H14O5.
如图所示下列物质最多与5molNaOH反应,最多与4molBr2反应,最多与9molH2反应.它的分子式为C20H14O5.
分析 有机物含有酚羟基,可发生取代反应,具有酸性,可与氢氧化钠反应,含有酯基,可发生水解反应,能与氢气发生加成反应的为苯环,以此解答.
解答 解:有机物含有2个酚羟基,且酯基可水解生成酚羟基和碳酸,则1mol有机物可与5molNaOH反应;
含有2个酚羟基,共有4个邻位H原子可被取代,则1mol有机物最多与4mol溴反应;
只有苯环与氢气发生加成反应,最多与9mol氢气反应,
由结构简式可知有机物分子式为,
故答案为:5;4;9;C20H14O5.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,解答该题要注意把握官能团的性质,仔细分析有机物的结构简式,能正确判断有机物的分子式,题目难度不大.

练习册系列答案
相关题目
5.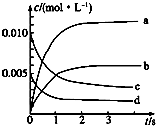 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)如图表示NO2的浓度变化的曲线是b.用O2表示从0~2s内该反应的平衡速率v=1.5×10-3mol•L-1•s-1.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
2.下列反应的离子方程式正确的是( )
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
9.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加入过量烧碱溶液 ③过滤 ④通入过量CO2生成Al(OH)3 沉淀⑤加入盐酸生成Al(OH)3沉淀.
①加盐酸溶解 ②加入过量烧碱溶液 ③过滤 ④通入过量CO2生成Al(OH)3 沉淀⑤加入盐酸生成Al(OH)3沉淀.
| A. | ①②⑤③ | B. | ②③④③ | C. | ②③⑤③ | D. | ①③⑤③ |
6.某化学小组准备用环己醇制备环己烯,查得相关资料如下.反应原理: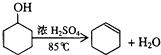
反应物与产物的物理性质:
(1)实验过程中可能发生的有机副反应的方程式为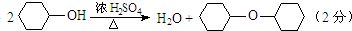 .
.
(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.
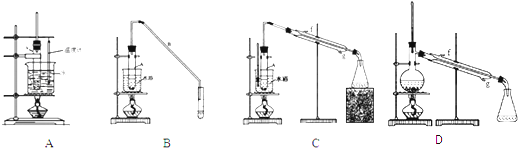
(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.

反应物与产物的物理性质:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 .
.(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.

(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.
7.下列离子方程式中正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | 大理石溶于醋酸的反应:CaCO3+CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
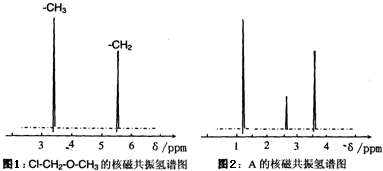
 .
.
 Na2S
Na2S
 CO2
CO2 .
.