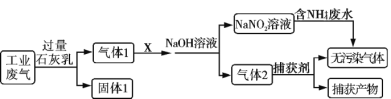
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如图:
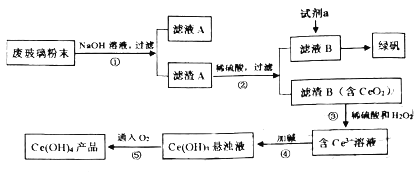
(1)写出第①步反应的离子方程式__。滤液A中的用途是___。
(2)向滤液B中加入过量试剂a可用于制备绿矾(FeSO4·7H2O),试剂a是__(填物质名称)充分反应后,经过滤得到FeSO4溶液。再经蒸发浓缩、冷却结晶、过滤、洗涤等操作步骤得到绿矾。检验所加试剂a已经过量,使用的试剂和判断的依据分别是__、__。
(3)写出第③步反应的化学方程式__。
(4)取上述流程中得到的Ce(OH)4[摩尔质量为208g·mol-1产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定(铈被还原为Ce3+)消耗20.00mL标准溶液,该产品中Ce(OH)4的质量分数为__(保留四位有效数字数)。若FeSO4标准溶液部分变质,会使测定结果__。(填“偏高”、“偏低”或“无影响”)
【答案】SiO2+2OH-=SiO32-+H2O 黏合剂、耐火阻燃材料、制备硅胶等 铁粉 KSCN溶液 溶液不变色 2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O 83.20% 偏高
【解析】
流程第①步反应废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2;滤渣A(Fe2O3、CeO2)加稀硫酸后过滤得滤液B是硫酸铁溶液,滤渣B的成分是CeO2;第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;第④步反应Ce3+加碱生成Ce(OH)3悬浊液;第⑤步反应Ce(OH)3悬浊液被氧化生成Ce(OH)4,据此分析解答。
(1)根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),可知能与氢氧化钠反应的是二氧化硅。其离子方程式为SiO2+2OH-=SiO32-+H2O,反应所得硅酸钠溶液作用有黏合剂、耐火阻燃材料、制备硅胶等,故答案为:SiO2+2OH-=SiO32-+H2O;黏合剂、耐火阻燃材料、制备硅胶等;
(2)滤液B是硫酸铁溶液,则试剂a为铁粉,若铁粉过量则溶液中没有Fe3+,检验Fe3+可以用KSCN溶液,若溶液不变色则说明没有Fe3+,说明试剂a已经过量,故答案为:铁粉;KSCN溶液;溶液不变色;
(3)第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,反应方程式为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O;
(4)根据氧化还原反应中电子转移守恒知,n(Ce(OH)4)=n(FeSO4)= 0.1000mol·L-1×0.02L=0.002mol,则Ce(OH)4的质量分数为![]() ;若FeSO4标准溶液部分变质,则消耗的标准液偏多,会使测定结果偏高,故答案为:83.20%;偏高。
;若FeSO4标准溶液部分变质,则消耗的标准液偏多,会使测定结果偏高,故答案为:83.20%;偏高。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案