��Ŀ����
����Ŀ��ij�о���ѧϰС��Թ���̿������������Ӧ���������ɷֽ����о���
��1���������
�ٸ÷�Ӧ�����������CO2 ��
�ڸ÷�Ӧ�����������CO��
�۸÷�Ӧ����������� ��
��2����Ʒ���
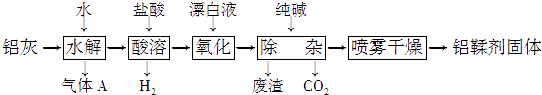
��ͼ��ʾ����һ�������������ڸ��������������������̿����ȫ��Ӧ���ⶨ�μӷ�Ӧ��̼Ԫ������Ԫ�ص������ȣ�
��������
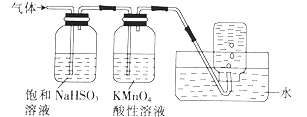
��������̼��������������Ӧ��ʵ���ҿ������Ȼ�隣�����Һ���������ƣ�NaNO2��������Һ��ϼ��ȷ�Ӧ�Ƶõ�������д���÷�Ӧ�����ӷ���ʽ�� ��
��3��ʵ�鲽��
�ٰ�ͼ����װ�ã������װ�õ������ԣ���ȡ3.20g��������2.00g̼�ۻ�Ͼ��ȣ�����48.48g��Ӳ�ʲ������У�
�ڼ���ǰ����ͨһ��ʱ�䴿������ĵ�����
��ֹͣͨ��N2�н����ɼУ�����һ��ʱ�䣬����ʯ��ˮ������������ǣ�
�ܴ���Ӧ�������ٻ���ͨ��һ��ʱ��ĵ�������ȴ�����£��Ƶ�Ӳ�ʲ����ܺ���������Ϊ52.24g��
�ݹ��˳�ʯ��ˮ�еij�����ϴ�ӡ���ɺ�Ƶ�����Ϊ2.00g��
����ڡ����ж��ֱ�ͨ��N2 �� �����÷ֱ�Ϊ ��
��4�����ݴ���
�Ը���ʵ�����ݷ�����д����ʵ������������̼������Ӧ�Ļ�ѧ����ʽ�� ��
��5��ʵ���Ż�
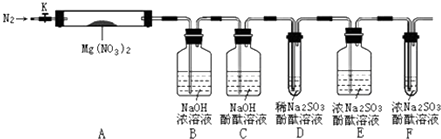
ѧϰС����ͬѧ��ΪӦ��ʵ��װ�ý�һ�����ƣ�
�ټ�ͬѧ��Ϊ��Ӧ������ʯ��ˮ����Ba��OH��2��Һ���������� ��
�ڴӻ��������ĽǶȣ����������һ���Ż���������ʵ��װ�ý�һ�����ƣ� ��
���𰸡�
��1��CO2��CO�Ļ����
��2��NH4++NO2�� ![]() N2��+2H2O
N2��+2H2O
��3�����������Ϊ���ž��������������Ϊ�˸ϳ����е�CO2 �� ȷ����ȫ����
��4��2C+Fe2O3 ![]() 2Fe+CO��+CO2��
2Fe+CO��+CO2��
��5�������������ܽ�ȴ�Ũ�ȴ�ʹ������̼�����յĸ���ȫ����β�����ڴ���һ��ȼ�ľƾ��ƻ�����һβ������װ��
���������⣺��1.���ٸ÷�Ӧ�����������CO2 �� �ڸ÷�Ӧ�����������CO���۸÷�Ӧ����������Ƕ�����̼��һ����̼�Ļ�����壬�ʴ�Ϊ��CO2��CO�Ļ���
��2.���Ȼ�隣�����Һ���������ƣ�NaNO2��������Һ��ϼ��ȷ�Ӧʱ�������ɵ������Ȼ��ƺ�ˮ����ѧ����ʽΪ��NaNO2+NH4Cl ![]() N2��+NaCl+2H20�����ӷ���ʽΪ��NH4++NO2��
N2��+NaCl+2H20�����ӷ���ʽΪ��NH4++NO2�� ![]() N2��+2H2O���ʴ�Ϊ��NH4++NO2��
N2��+2H2O���ʴ�Ϊ��NH4++NO2�� ![]() N2��+2H2O��
N2��+2H2O��
��3.������ڡ����ж��ֱ�ͨ��N2 �� �����÷ֱ�Ϊ���ž�װ���еĿ�����ʹ���ɵĶ�����̼ȫ����ʯ��ˮ���գ��ʴ�Ϊ���ž�װ���еĿ�����ʹ���ɵĶ�����̼ȫ����ʯ��ˮ���գ�
��4.�����������������3.20g+2.00g+48.48g��52.4g=1.28g��
�������̼������ΪX��
Ca��OH��2+CO2=CaCO3��+H2O��
44 100
X 2.00g
X=0.88g����������������������̼������֮��������ɵ�һ����̼��������һ����̼������Ϊ��1.28g��0.88g=0.4g������ʵ�����ݷ�������ʵ������������̼������Ӧ��������һ����̼�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+2C ![]() 2Fe+CO2��+CO����
2Fe+CO2��+CO����
�ʴ�Ϊ��Fe2O3+2C ![]() 2Fe+CO2��+CO����
2Fe+CO2��+CO����
��5.���ټ�ͬѧ��Ϊ��Ӧ������ʯ��ˮ����Ba��OH��2��Һ������������������������ˮ���ܽ�ȴ�Ũ�ȴ�������ո���Ķ�����̼���ʴ�Ϊ�������������ܽ�ȴ�Ũ�ȴ�ʹ������̼�����յĸ���ȫ���ڴӻ��������ĽǶȣ�Ӧ�ö�β�����д����������ǵ�ȼ���ռ�β�����������Ϊ����β�����ڴ���һ��ȼ�ľƾ��ƻ�����һβ������װ�ã��ʴ�Ϊ����β�����ڴ���һ��ȼ�ľƾ��ƻ�����һβ������װ�ã�
��1����Ӧ��������Ƕ�����̼��һ����̼���������̼��һ����̼����3�����Ȼ�隣�����Һ���������ƣ�NaNO2��������Һ��ϼ��ȷ�Ӧ�Ƶõ������Ȼ��ƺ�ˮ�����ݷ�Ӧ������P�������غ㶨�ɿ�����д��ѧ����ʽ����4�������к��ж�����̼���ֱ�ͨ��N2 �� �����÷ֱ�Ϊ���ž�װ���еĿ�����ʹ���ɵĶ�����̼ȫ����ʯ��ˮ���գ���5������ʵ�����ݷ�����֪����ʵ������������̼������Ӧ����������һ����̼�Ͷ�����̼����6�������������������Ƹ�������ˮ��β����ɢ�������л���Ⱦ��������Ҫβ��������