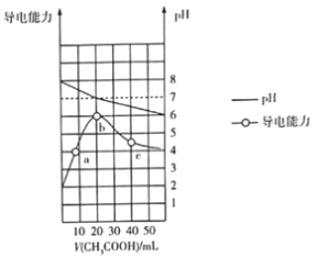
题目内容
【题目】某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X。为确定其组成,进行如下实验:
Ⅰ.结晶水的测定:称取7.84 g浅蓝绿色晶体,加热至100 ℃失去结晶水,冷却至室温后,称重,质量为5.68 g。
Ⅱ.NH4+的测定:将上述5.68 g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%的NaOH溶液,通入氮气,用40.00 mL 1 mol·L-1的硫酸溶液吸收产生的氨气。吸收氨气结束后取下接收瓶,用2 mol·L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00 mL NaOH溶液。
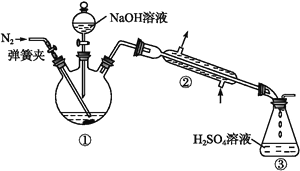
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的溶液全部倒入锥形瓶中,向其中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后;测得其质量为1.6 g。回答下列问题:
(1)在实验Ⅰ中,不可能用到的实验仪器是_____(填正确答案标号)。
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是____________。吸收氨气结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_______________。
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用_______式滴定管;可使用的指示剂为_______________。
(4)在实验中,检验沉淀是否洗净的方法是____________________。
(5)根据上述实验数据计算,该浅蓝绿色晶体的化学式为________。三颈瓶中发生反应的离子方程式为_____________________________。
【答案】AD使溶液中的氨全部逸出用蒸馏水冲洗冷凝管装置2~3次,洗涤液并入锥形瓶中碱酚酞(或甲基橙)取最后一次洗涤液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净FeSO4·(NH4)2SO4·6H2O或(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4·FeSO4·6H2O2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O
【解析】
(1)结晶水的测定,称量需要托盘天平,加热需要酒精灯、坩埚、铁架台、玻璃棒,干燥时需要干燥器等,无须使用烧杯和蒸发皿,答案选AD。
(2)实验Ⅱ的目的是测定铵根离子的含量,通过铵根离子和碱反应生成氨气的量测定,将氨气全部赶出,为减小误差需要通入氮气使溶液中的氨全部逸出。由于冷凝管中还有残留的液体,因此吸收氨气结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是用蒸馏水冲洗冷凝管装置2~3次,洗涤液并入锥形瓶中。
(3)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用氢氧化钠标准溶液确定过剩的硫酸时,应使用碱式滴定管盛放氢氧化钠溶液。氢氧化钠和硫酸溶液反应后显中性,可以选择酸性或碱性变色范围内的指示剂,所以可以选择酚酞(或甲基橙)。
(4)溶液中存在硫酸铵,若未洗净,加入1~2滴稀硝酸,在滴入硝酸钡溶液,有白色沉淀生成,所以检验沉淀是否洗净的方法是:取最后一次洗涤液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净。
(5)由题中数据可知7.84g摩尔盐中,水的质量为7.84g-5.68g=2.16g,物质的量为2.16g÷18g/mol=0.12mol,消耗氢氧化钠的物质的量为0.04mol,则根据反应式可知剩余硫酸的物质的量为0.02mol,则根据氨气与硫酸的反应分析,与氨气反应的硫酸的物质的量为0.04mol-0.02mol=0.02mol,则与硫酸反应的氨气的物质的量为0.02mol×2=0.04mol,生成的氨气的质量为0.68g,氧化铁的质量为1.6g,氧化铁的物质的量为0.01mol,铵根离子的质量为0.04mol×18g/mol=0.72g,亚铁离子的质量为0.02mol×56g/mol=1.12g,则硫酸根离子的质量为7.84g-2.16g-0.72g-1.12g=3.84g,物质的量为3.84g÷96g/mol=0.04mol,所以铵根离子:亚铁离子:硫酸根离子:水的物质的量之比为=0.04:0.02:0.04:0.12=2:1:2:6,则该晶体的化学式为:FeSO4·(NH4)2SO4·6H2O或(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4·FeSO4·6H2O;三颈烧瓶中亚铁离子、铵根离子和氢氧根离子反应生成氢氧化亚铁、氨气和水,离子方程式为2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O。

【题目】中科院官微曾给出灰霾中细颗粒物的成因,部分分析如下图所示。

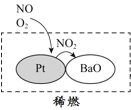
(1)根据如图信息可以看出,所列的气体污染物并非由机动车行驶造成的是______。汽车发动机废气稀燃控制系统主要工作原理如上右图所示;写出稀燃过程中NO发生的主要反应的方程式_____________________________________。
(2)农业活动排出的氨可能是施用的化肥分解,也可能是施用不当导致的。比如某些氮肥与碱性肥料混合施用会释出氨,用离子方程式解释________________________。
(3)经过研究发现我国的霾呈中性,其主要原因如下图所示,A的化学式是________。
2NH3(气)+SO2(气)+2NO2(气)![]() 2NH4+(溶液)+A(溶液)+2HONO(气)
2NH4+(溶液)+A(溶液)+2HONO(气)
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他极微量离子忽略不计):
离子 | Na+ | SO42- | NO3- | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.8×104 | 3.5×103 |
①NO和NaClO2溶液反应的离子方程式是___________________。
②表中y=_______。
(5)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式___________________________________。
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②