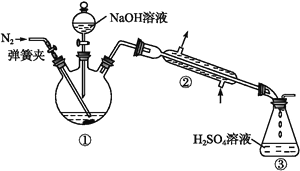
题目内容
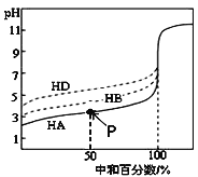
【题目】298K时向20mL0.1mol·L-1MOH 溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH 及导电能力变化如图所示,下列叙述正确的是( )
A. MOH 是强电解质
B. b点对应的盐不水解
C. c 点溶液中:c(CH3COO-)>c(M+)>c(H+)>c(OH-)
D. a 点溶液中:c(OH-)+c(CH3COO-)+)+c(M+)
【答案】C
【解析】试题分析:由图像可知,0.1mol·L-1MOH溶液的pH为8而不是13,说明MOH是弱碱,故其为弱电解质。在a点溶液中有OH-、CH3COO-、H+、M+等4种离子,由电荷守恒可知,OH-)+c(CH3COO-)=c(H+)+c(M+)。在b点,两者恰好完全反应生成弱酸弱碱盐CH3COOM,该盐水解后溶液的pH=6,溶液显弱酸性,说明M+的水解程度大于CH3COO-的水解程度,所以在b点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)。在c点,醋酸过量使溶液酸性增强,依据电荷守恒可以判断,溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)。在一定温度下,水的离子积是定值,其值不随溶液的pH变化而变化。综上所述,C正确,本题选C。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H