题目内容
【题目】分别向盛有等物质的量浓度的稀硫酸和氢氧化钠溶液的烧杯中加入足量的铝,反应后放出的气体体积在标准状况下为1︰2,则所取稀硫酸和氢氧化钠溶液的体积比为
A. 1︰2 B. 3︰4 C. 3︰2 D. 6︰1
【答案】B
【解析】
反应的有关方程式为:铝与硫酸反应:2Al+3H2SO4=2Al2(SO4)3+3H2↑,铝与NaOH溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
因铝足量,则根据方程式中氢气与酸、碱物质的关系式分别计算H2SO4、NaOH的物质的量,稀硫酸和氢氧化钠溶液的物质的量浓度相等,所以所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH的物质的量的之比。
为方便计算,可令生成的氢气的物质的量分别为3 mol和6 mol,消耗的稀硫酸的物质的量为x,氢氧化钠的物质的量为y,则: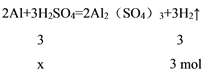
解得x = ![]() = 3 mol,
= 3 mol,
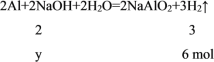
解得y = ![]() = 4 mol,又因稀硫酸和氢氧化钠溶液的物质的量浓度相等,则所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH 的物质的量的之比,即为3 mol:4 mol = 3:4,故B项正确;
= 4 mol,又因稀硫酸和氢氧化钠溶液的物质的量浓度相等,则所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH 的物质的量的之比,即为3 mol:4 mol = 3:4,故B项正确;
答案选B。

【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H