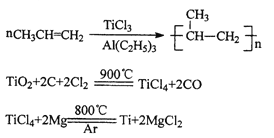
题目内容
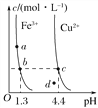
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
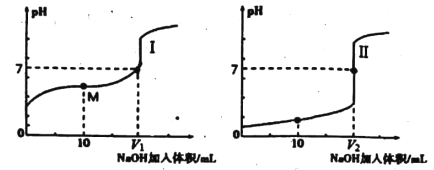
(1)用NaOH溶液滴定醋酸溶液通常所选择的指示剂为________;符合其滴定曲线的是______(填“I”或“Ⅱ”)。
(2)图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”)。
(3)滴定前的上述三种溶液中。由水电离出的c(H+)最大的是_____溶液(填化学式)。
(4)若用0.1mol/LNaOH溶液滴定未知浓度的醋酸,滴定前仰视,滴定后平视,则所测结果____(填“偏低”,“偏高”或“不变”)。
【答案】 酚酞 I < CH3COOH 偏低
【解析】(1)滴定终点尽可能落在指示剂变色范围之间,用NaOH溶液滴定醋酸溶液通常所选择的指示剂为:酚酞;醋酸为弱酸,盐酸为强酸,等物质的量浓度时醋酸的pH大,则图I为滴定醋酸曲线。
(2)常温下等体积等物质的量浓度的盐酸和醋酸分别与NaOH溶液恰好完全反应时,所得溶液前者pH=7、后者pH>7,图I为滴定醋酸的曲线,图Ⅱ为滴定盐酸的曲线,图中V1和V2对应的纵坐标都是7,所以V1<V2。
(3)上述三种溶液中溶质的物质的量浓度相等,CH3COOH是弱酸,不完全电离,对水的电离的抑制作用最小,所以CH3COOH溶液中由水电离出的c(H+)最大。
(4)根据c(待)= 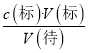 分析不当操作对V(标)的影响,滴定前仰视,滴定后平视,造成V(标)偏小,c(待)偏小,则所测结果偏低。
分析不当操作对V(标)的影响,滴定前仰视,滴定后平视,造成V(标)偏小,c(待)偏小,则所测结果偏低。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目