题目内容
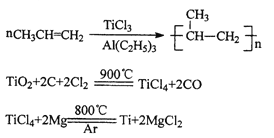
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
(1)Ti3+的基态核外电子排布式为__________
(2)丙烯分子中,碳原子轨道杂化类型为__________
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______.
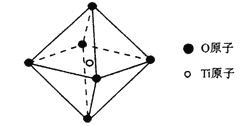
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________
【答案】 [Ar]3d1 sp2、sp3 Cl>Mg>Al ![]() 18 mol SrTiO3
18 mol SrTiO3
【解析】(1)钛是22号元素,Ti3+核外有19个电子,根据构造原理知其基态核外电子排布式为:[Ar]3d1,答案为:[Ar]3d1
(2)丙烯结构是CH2=CH-CH3,碳碳单键是sp3杂化,碳碳双键(π键)是sp2杂化,答案为:sp2、sp3
(3)同周期,同周期自左而右元素的第一电离能呈增大趋势,但Mg最外层3s能级容纳2个电子,为全满确定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能Cl>Mg>Al,答案为:Cl>Mg>Al
(4) 原子数目和价电子数相等的微粒互为等电子体,所以与CO互为等电子体的阴离子为CN-或C22-,电子式分别为:![]() ,答案为:
,答案为:![]()
(5)1个[Ti(H2O)6]Cl3含有12个O-H键和6个配位键,因此有18个σ键,所以1mol[Ti(H2O)6]Cl3中含有18molσ键 ,答案为:18 mol
(6)在1个晶胞内,Sr位于晶胞的顶点,Sr的个数为:8![]() =1,O位于晶胞的面心,O的个数为:6
=1,O位于晶胞的面心,O的个数为:6![]() =3,Ti原子填充在O原子构成的正八面体空隙的中心位置,说明Ti原子在晶胞的内部,Ti原子的个数为:1,所以钛酸锶的化学式为:SrTiO3,答案为:SrTiO3
=3,Ti原子填充在O原子构成的正八面体空隙的中心位置,说明Ti原子在晶胞的内部,Ti原子的个数为:1,所以钛酸锶的化学式为:SrTiO3,答案为:SrTiO3

 名校课堂系列答案
名校课堂系列答案