题目内容
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
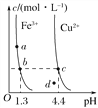
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
【答案】B
【解析】试题分析:A.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)(OH-)3=c(Fe3+)(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)(OH-)2=c(Cu2+)(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故A正确;B.向溶液中加入NH4Cl固体,不会导致溶液中的c(OH-)增大,故不能使溶液由a点变到b点,故B错误;C.只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,故C正确;D.b、c两点分别处在两条的沉淀溶解平衡曲线上,故两点均代表溶液达到饱和,故D正确;故选B。

练习册系列答案
相关题目