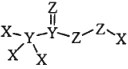题目内容
【题目】锌锰干电池的负极材料是电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生Mn2O3。利用废旧电池回收Zn、Mn化合物,对环境保护意义重大。
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得到固体和滤液。
步骤二:处理固体,提取MnO2通过对获得的滤渣进行灼烧,灼烧的目的是__。灼烧时用到的实验仪器有酒精灯、玻璃棒、__。
步骤三:处理滤液,得到ZnCl2·xH2O晶体,再通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2。有关的实验装置如图(夹持及加热装置略):
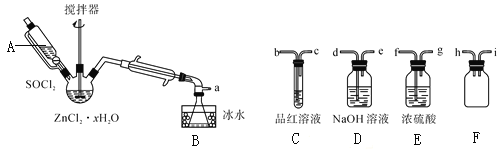
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃。140℃以上易分解,与水剧烈反应生成两种气体。
①仪器A的名称为__。
②蒸馏烧瓶中发生反应的化学方程式为:__。
③为回收剩余的SOCl2并验证生成物中含有SO2。上述仪器接目的连接响序为a→__。装置E中浓硫酸的作用___。
④为提高SOCl2的利用率,该实验宜采用的加热方式为__。
⑤讨论:将ZnCl2·xH2O晶体置于坩埚中加热均烧,__(能,不能)得到无水ZnCl2,原因是__。
【答案】除去碳粉,并将Mn2O3氧化为MnO2 坩埚、坩埚钳、泥三角、三角架 恒压漏斗 xSOCl2+ZnCl2·xH2O=ZnCl2+xSO2↑+2xHCl↑ fghibcde 浓硫酸吸收水蒸气,防止后面溶液中的水蒸气进入装置B的锥形瓶中,导致SOCl2水解 水浴加热 否 因为ZnCl2+2H2O![]() Zn(OH)2+2HCl为吸热反应,加热,平衡正移,HCl挥发,得到Zn(OH)2固体受热分解,最终得到ZnO固体
Zn(OH)2+2HCl为吸热反应,加热,平衡正移,HCl挥发,得到Zn(OH)2固体受热分解,最终得到ZnO固体
【解析】
锌锰干电池的负极材料是电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生Mn2O3,二氧化锰、碳粉和Mn2O3难溶于水,则除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得到固体和滤液,固体的主要成分为二氧化锰、碳粉和Mn2O3,对滤渣进行灼烧除去碳粉并将Mn2O3氧化为MnO2;滤液的主要成分为氯化锌和氯化铵,处理滤液得到ZnCl2·xH2O晶体,再通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2。
综上分析步骤二的目的是提取MnO2,故对获得的滤渣进行灼烧,灼烧时碳粉与氧气反应生成二氧化碳、Mn2O3被氧化成MnO2;灼烧时用到的实验仪器有酒精灯、玻璃棒、坩埚、坩埚钳、泥三角、三角架。
①根据仪器A的图示可知,其名称为恒压漏斗。
②实验中通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2并生成SO2、HCl,故蒸馏烧瓶中发生反应的化学方程式为xSOCl2+ZnCl2·xH2O=ZnCl2+xSO2↑+2xHCl↑。
③验证生成物中含有SO2,需要的试剂为品红溶液,但根据信息可知,SOCl2易水解,为防止装置中水蒸气和溶液中水蒸气进入装置B的锥形瓶中使SOCl2水解,故需在装置B与C之间放置E和F,装置F是为了防止液体倒吸,同时二氧化硫有毒,故需要氢氧化钠溶液吸收尾气,故上述仪器接目的连接响序为a→fghibcde。
④因SOCl2的沸点较低并140℃以上易分解,故为提高SOCl2的利用率,该实验宜采用的加热方式为水浴加热。
⑤ZnCl2在水溶液中存在水解平衡,ZnCl2+2H2O![]() Zn(OH)2+2HCl为吸热反应,加热,平衡正移,HCl挥发,得到Zn(OH)2固体受热分解,最终得到ZnO固体,而不能得到无水ZnCl2,故将ZnCl2·xH2O晶体置于坩埚中加热均烧不能得到无水ZnCl2。
Zn(OH)2+2HCl为吸热反应,加热,平衡正移,HCl挥发,得到Zn(OH)2固体受热分解,最终得到ZnO固体,而不能得到无水ZnCl2,故将ZnCl2·xH2O晶体置于坩埚中加热均烧不能得到无水ZnCl2。

【题目】钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3![]() TiCl4↑+TiCl2回答下列问题。
TiCl4↑+TiCl2回答下列问题。
(1)某同学所画基态 Cl-的外围电子排布图为![]() ,这违反了____________
,这违反了____________
(2)从结构角度解释 TiCl3中Ti(III)还原性较强的原因____________。
(3)钛的氯化物的部分物理性质如下表:
氯化物 | 熔点/℃ | 沸点/℃ | 溶解性 |
TiCl4 | -24 | 136 | 可溶于非极性的甲苯和氯代烃 |
TiCl2 | 1035 | 1500 | 不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是____________。
②TiCl4与SO42-互为等电子体,因为它们____________相同;SO42-中心原子以3s轨道和3p轨道杂化。
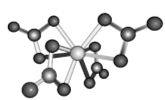
(4)Ti的配合物有多种。Ti(CO)6、Ti(H2O)63+、TiF62-的配体所含原子中电负性最小的是__________;Ti(NO3)4的球棍结构如图,Ti的配位数是_____________
(5)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图:
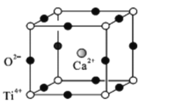
①设N为阿伏加德罗常数的值,计算一个晶胞的质量为______________g.
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则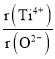 =_________。
=_________。