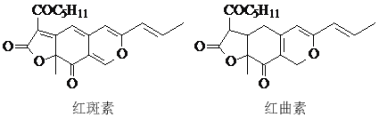
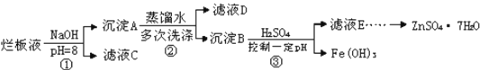
题目内容
【题目】短周期元素X、Y、Z在元素周期表中的相对位置如表所示,其中X、Y、Z元素的原子最外层电子数之和为15。下列说法正确的是( )
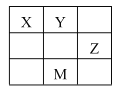
A.原子半径大小:Z>Y>X
B.简单氢化物沸点:X>Y
C.Z元素与X元素可形成直线形的共价化合物
D.M的原子序号为33,其最高价氧化物对应的水化物为强酸
【答案】C
【解析】
短周期元素X、Y、Z在元素周期表中的相对位置如表所示,则X、Y为二周期,Z为三周期,M为四周期,设Y的最外层电子数为a,X的最外层电子数为a-1,Z的最外层电子数为a+1,a-1+a+a+1=15,a=5,则Y为氮,X为碳,Z为硫,M为砷。
A.原子半径从左到右依次减小,从上到下依次增大,故原子半径大小:Z>X>Y,A不正确;
B. X简单氢化物为甲烷,Y的简单氢化物为氨气,氨气分子间可以形成氢键,沸点更高,故沸点:Y>X,B不正确;
C. Z元素与X元素可形成CS2,CS2为SP2杂化,为直线形的共价化合物,C正确;
D. M为砷,原子序号为33,磷酸为中强酸,而砷的非金属性小于N,非金属性越弱,其最高价氧化物对应的水化物的酸性越弱,故砷的最高价氧化物对应的水化物不可能是强酸,D不正确。
答案选C。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
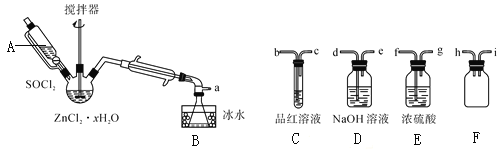
轻巧夺冠周测月考直通名校系列答案【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。