题目内容
【题目】已知某二元酸H2MO4在水中电离分以下两步:H2MO4H++HMO4-,HMO4-H++MO42-。常温下向20 mL0.1mol/L NaHMO4溶液中滴入cmol/LNaOH溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是

A.该氢氧化钠溶液pH=12
B.图像中F点对应的溶液中c(OH-)>c(HMO4-)
C.滴入NaOH溶液过程中水的电离程度一直增大
D.图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
【答案】B
【解析】
根据图像可知, NaHMO4与NaOH发生反应是放热反应,当温度达到最高,说明两者恰好完全反应,F点温度最高,此时消耗NaOH的体积为20mL ,计算出氢氧化钠的浓度,然后根据影响水电离的因素、“三大守恒”进行分析。
A.根据图像分析可知,F点温度最高,说明此时两物质恰好完全反应,NaHMO4+ NaOH = Na2MO4+H2O,20×10-3L×0.1molL-1=20×10-3L×c(NaOH),推出c(NaOH)=0.1mol/L,c(H+)=![]() =
=![]() =10-13mol/L,则pH=13,故A错误;
=10-13mol/L,则pH=13,故A错误;
B.F点溶质为Na2MO4,溶液中质子守恒为c(OH-)=c(H+)+c(HMO4-)+2c(H2MO4),所以c(OH-)>c(HMO4-),故B正确;
C.根据题意,两者恰好完全反应,生成的溶质Na2MO4,属于强碱弱酸盐,即溶质为Na2MO4时,水解程度最大, E到F过程中,水的电离程度增大,F到G过程中,氢氧化钠溶液过量,抑制水的电离,因此滴加氢氧化钠的过程中,水的电离程度先变大,后变小,故C错误;
D.由A选项推出c(NaOH)=0.1mol/L,G点加入40mL等浓度的NaOH溶液,反应后溶质为等浓度的NaOH和Na2MO4,Na+的浓度最大,MO42部分水解,溶液显碱性,则c(OH)> c(H+),溶液中存在电荷守恒:c(Na+)+c(H+)=2c(MO42)+c(HMO4-)+c(OH),则c(Na+)<c(HMO4-)+2c(MO42-),故D错误;
答案选B。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
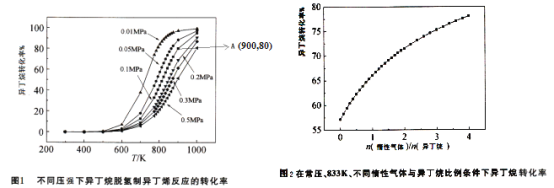
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。