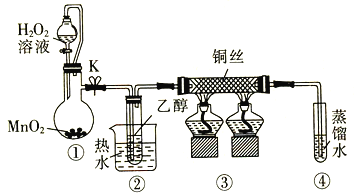
题目内容
【题目】用 NA 表示阿伏加德罗常数,下列说法中正确的是
A.1 L 1 mol·L-1 的醋酸溶液中 H+的数目为 NA
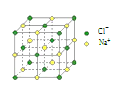
B.4 mol NaCl 晶体中含有右图所示的结构单元的数目为 NA
C.71 g Cl2 通入水中,HClO、Cl-两种粒子数目总和为 2NA
D.标准状况下,22.4 L CHCl3 和 CCl4 的混合物所含有分子数目为 NA
【答案】B
【解析】
A.醋酸是弱酸,电离方程式为:CH3COOH![]() CH3COO-+H+,故1 L 1 mol·L-1 的醋酸溶液中H+的数目小于NA,A错误;
CH3COO-+H+,故1 L 1 mol·L-1 的醋酸溶液中H+的数目小于NA,A错误;
B.从结构单元图上可知,8个Cl-在顶点,6个Cl-在面心,12个Na+在棱上,1个Na+在体心,故该结构单元中Cl-的数目:![]() ,该结构单元中Cl-的数目:
,该结构单元中Cl-的数目:![]() ,即4mol NaCl晶体中含有该结构单元的数目为 NA,B正确;
,即4mol NaCl晶体中含有该结构单元的数目为 NA,B正确;
C.71 g Cl2的物质的量是1mol,Cl2+H2O![]() HCl+HClO,溶液中含有氯元素的微粒:Cl2、HClO、Cl-,所以HClO、Cl-两种粒子数目总和小于 2NA,C错误;
HCl+HClO,溶液中含有氯元素的微粒:Cl2、HClO、Cl-,所以HClO、Cl-两种粒子数目总和小于 2NA,C错误;
D.标准状况下,CHCl3和CCl4是液体,不能运用气体摩尔体积计算该混合物的物质的量,D错误;
答案选B。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,该反应是_________反应(填“放热”或“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各4.0 mol,反应经过20min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=__________、CO的平衡转化率=__________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________
A.降低反应温度 B.增加Fe2O3的量 C.加入合适的催化剂 D.移出部分CO2 E.减小容器的容积
(4)在1L的密闭容器中,1150℃条件,下列达平衡状态的是__________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.037 | 0.050 |