��Ŀ����
18�� U��V��W��Y��Z��ԭ��������������Ķ���������Ԫ�أ�U��Y�����ڱ��е����λ�����ұ���UԪ������Ԫ�����γ�������ɫ���壻W�ǵؿ��к������Ľ���Ԫ�أ�
U��V��W��Y��Z��ԭ��������������Ķ���������Ԫ�أ�U��Y�����ڱ��е����λ�����ұ���UԪ������Ԫ�����γ�������ɫ���壻W�ǵؿ��к������Ľ���Ԫ�أ�| U | ||
| Y |
��2��YO2����ͨ��BaCl2��HNO3�Ļ����Һ�����ɰ�ɫ��������ɫ����VO���йط�Ӧ�����ӷ���ʽΪ3SO2+2NO3-+3Ba2++2H2O=3BaSO4��+2NO+4H+���ɴ˿�֪YO2��VO��ԭ�Խ�ǿ���ǣ�д��ѧʽ��SO2��
��3��V�������̬�⻯���ˮ��Һ�Լ��ԣ�
�������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2�����������������Ӧ�IJ��ﲻ��Ⱦ�������仯ѧ����ʽΪ2NH3+3H2O2=N2+6H2O��
��һ�������£����ڹ̶�������ܱ������з����ֽⷴӦ����H��0������ƽ����ı��±��з�Ӧ����x����ƽ����ϵ����x����y��������bc������ţ���
| ѡ�� | a | b | c | d |
| X | �¶� | �¶� | ����H2�����ʵ��� | ��������ʵ��� |
| y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ�ļ�ת���� |
����4mol V����ۺ������ϡ��Һ�У�����Fe�����������������ɵ�����ֻ��һ�֣�VO������������ϵ�л���n��Fe2+����n��Fe���仯��ʾ��ͼ��
��4����ͬ�¶��£�����������ʵ���Ũ�ȶ�Ϊ0.1mol/L��KZ��CH3COOK��Һ��������Һ�У�����������Ƚ�A��������ţ�
A��ǰ�߶� B��һ����C�����߶� D�����жϣ�
���� U��V��W��Y��Z��ԭ��������������Ķ���������Ԫ�أ�W�ǵؿ��к������Ľ���Ԫ�أ���W��AlԪ�أ���U��Y�����ڱ��е����λ����֪��UΪ�ڶ�����Ԫ�أ�UԪ������Ԫ�����γ�������ɫ���壬��U��CԪ�أ�Y��SԪ�أ�Z��ԭ����������SԪ����Ϊ����������Ԫ�أ�����Z��ClԪ�أ���3����V�������̬�⻯���ˮ��Һ�Լ��ԣ���V��NԪ�أ����ǰ�����
��1������Ԫ��ԭ������������������������ȣ�Al�������͵������Һ����ԭ��أ�Al��ʧ������������
��2��SO2����ͨ��BaCl2��HNO3�Ļ����Һ�����ɰ�ɫ��������ɫ����NO������������ԭ��Ӧ������������Ӻ�NO����������Ӻͱ����ӷ�Ӧ�������ᱵ��ɫ������ͬһ������ԭ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�
��3���ٰ�����˫��ˮ����������ԭ��Ӧ���ɵ�����ˮ��
��һ�������£����ڹ̶�������ܱ������з����ֽⷴӦ����H��0������ƽ���
a���÷ֽⷴӦ�����ȷ�Ӧ�������¶ȴٽ��ֽ⣬���������ʵ�������
b�������¶ȣ��ٽ������ֽ⣻
c���������������ư����ֽ⣬�������������������������䣬���ݦ�=$\frac{m}{V}$�жϣ�
d�����백��������Ũ������ƽ�������ƶ���������ת���ʼ�С��
���¶�ΪT��ʱ����2a molH2��a molN2����0.5L�ܱ������У�������ӦN2��g��+3H2��g��?2NH3��g����H��0������ƽ��ʱ��������ʵ���Ũ�ȣ�����K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$����ƽ�ⳣ����
�ܺ���4mol�����ϡ������Һ�У�����Fe���������������ķ�ӦΪFe+4HNO3=Fe��NO3��3+NO��+2H2O��2Fe��NO3��3+Fe=3Fe��NO3��2��4mol��������������������ʱ��Ҫ1molFe��������������������������ʱ��Ҫ0.5mol�������������������ӵ����ʵ�����1.5mol��
��ͬ�¶��£�����������ʵ���Ũ�ȶ�Ϊ0.1mol/L��KCl��CH3COOK��Һ��������Һ�У�KCl�д���c��K+��+c��OH-��=c��H+��+c��Cl-����CH3COOK��Һ�д���C��CH3COO-��+c��OH-��=c��H+��+c��K+�����������Һ�ʼ��ԡ��Ȼ�����Һ�����ԣ�������Һ�м�����Ũ����ȣ��ݴ��жϣ�
��� �⣺U��V��W��Y��Z��ԭ��������������Ķ���������Ԫ�أ�W�ǵؿ��к������Ľ���Ԫ�أ���W��AlԪ�أ���U��Y�����ڱ��е����λ����֪��UΪ�ڶ�����Ԫ�أ�UԪ������Ԫ�����γ�������ɫ���壬��U��CԪ�أ�Y��SԪ�أ�Z��ԭ����������SԪ����Ϊ����������Ԫ�أ�����Z��ClԪ�أ���3����V�������̬�⻯���ˮ��Һ�Լ��ԣ���V��NԪ�أ����ǰ�����
��1��ZΪClԪ�أ���ԭ�Ӻ�����3�����Ӳ㡢�������7�����ӣ�����Ԫ��ԭ�ӵ��Ӳ�������������ȡ�����������������������ȣ�����ClԪ��λ�ڵ������ڵ�VIIA�壻
��ԭ�����Al��ʧ���ӷ���������Ӧ�����������缫��ӦʽΪAl-3e-=Al3+��
�ʴ�Ϊ��VIIA�壻Al-3e-=Al3+��
��2��SO2����ͨ��BaCl2��HNO3�Ļ����Һ������������ԭ��Ӧ�������ᱵ��NO����Ӧ���ӷ���ʽΪ��3SO2+2NO3-+3Ba2++2H2O=3BaSO4��+2NO+4H+��ͬһ������ԭ��Ӧ�У���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ��÷�Ӧ�ж��������ǻ�ԭ����NO�ǻ�ԭ������Ի�ԭ�Զ��������ǿ��
�ʴ�Ϊ��3SO2+2NO3-+3Ba2++2H2O=3BaSO4��+2NO+4H+��SO2��
��3���������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2�����������������Ӧ�IJ��ﲻ��Ⱦ������˵�����߷���������ԭ��Ӧ���ɵ�����ˮ����Ӧ����ʽΪ2NH3+3H2O2=N2+6H2O��
�ʴ�Ϊ��2NH3+3H2O2=N2+6H2O��
��һ�������£����ڹ̶�������ܱ������з����ֽⷴӦ2NH3��g��?N2��g��+3H2��g����H��0��
a���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ�����������ʵ������������������䣬��������Է���������С���ʴ���
b��ƽ�ⳣ��ֻ���¶��йأ��¶ȸı�ƽ�ⳣ���ı䣬�����¶ȣ�ƽ��������Ӧ�����ƶ�����ƽ�ⳣ��������ȷ��
c�������������������������������������䣬���ܶ�������ȷ��
d�����백����ƽ��������Ӧ�����ƶ�������ת���ʼ�С���ʴ���
��ѡbc��
���¶�ΪT��ʱ����2a molH2��a molN2����0.5L�ܱ������У�������ӦN2��g��+3H2��g��?2NH3��g����H��0����ַ�Ӧ����N2��ת����Ϊ50%����μӷ�ӦN2�����ʵ���Ϊ0.5amol���μӷ�Ӧ�����������ʵ���=1.5amol�����ɰ��������ʵ���Ϊamol����ƽ����ϵ��c��N2��=$\frac{��1-0.5a��mol}{0.5L}$=amol/L��c��H2��=$\frac{��2a-1.5a��mol}{0.5L}$=amol/L��c��NH3��=$\frac{amol}{0.5L}$=2amol/L��
��ѧƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{��2a��^{2}}{a��{a}^{3}}$=$\frac{4}{{a}^{2}}$��
�ʴ�Ϊ��$\frac{4}{{a}^{2}}$��
����4molϡ������Һ������Fe����������Fe�Ⱥ�ϡ���ᷴӦ������������NO����������ȫ��Ӧ��Fe�ٺ������ӷ�Ӧ�����������ӣ������ķ�ӦΪFe+NO3-+4H+=Fe3++NO��+2H2O��2Fe3++Fe=3Fe2+�����ݷ���ʽ֪��4mol�������ܽ�1molFe��ͬʱ����1mol�����ӡ�1molNO��1molFe�����ܱ�0.5molFe��ԭ����ʱû��NO������������ͼ��Ϊ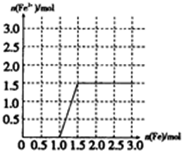 ��
��
�ʴ�Ϊ�� ��
��
��4����ͬ�¶��£�����������ʵ���Ũ�ȶ�Ϊ0.1mol/L��KCl��CH3COOK��Һ��������Һ�У����ݵ���غ��c��H+��+c��K+��=c��OH-��+c��Cl-����c��H+��+c��K+��=C��CH3COO-��+c��OH-�������������ˮ�⡢�����Ӳ�ˮ�⣬����������Һ��������Ũ�ȣ�KCl��CH3COOK��������Һ�м�����Ũ����ȣ���Һ�����ȣ�������������KCl��CH3COOK����ѡ��A��
���� ���⿼��λ�ýṹ�������ϵӦ�á�����������С�Ƚϡ�������ԭ��Ӧ����ѧƽ�ⳣ�����㡢ԭ���ԭ������ѧ�����֪ʶ�㣬��Ŀ�ۺ���ǿ����Ҫѧ���߱���ʵ�Ļ�����

| A�� | ��ͬ���ʵ���Ũ�ȵ�����Һ�е�c��OH-����� | |
| B�� | pH=13������Һϡ��100����pH��Ϊ11 | |
| C�� | ����Һ�зֱ��������NH4Cl���壬c��OH-������С | |
| D�� | �����ͬ��pH��ͬ������Һ���к͵����ʵ��������� |
| A�� | �ڳ��³�ѹ�£�11.2 ���������еķ�����Ϊ0.5NA | |
| B�� | 1 molFe��������Cl2��Ӧת�Ƶĵ�����Ϊ2NA | |
| C�� | ���³�ѹ�£�32 g O2��O3�Ļ����������ԭ����Ϊ2NA | |
| D�� | ���³�ѹ�£�1 mol�������е�ԭ����Ϊ2NA |
| A�� | 6W% | B�� | 3W% | C�� | ����3W% | D�� | ��3W% |
| A�� | 100 mL | B�� | 150 mL | C�� | 450 mL | D�� | ������ |
| A�� | Ӥ��ʳƷ�ڲ��ܼ����κ���ɫ�� | |
| B�� | ȱ����Ԫ�ؿɵ����������㣬��ͨ��ʳ�ú���Ʒ�����Ԫ�� | |
| C�� | ȱ����Ԫ�ؿɵ��¼�״���״�ͨ��ʳ�ö������ࡢ����ȫѪ�Ȳ�����Ԫ�� | |
| D�� | ȱ��ά����A�ɵ���ҹä֢����ͨ��ʳ�ö�����ಹ��ά����A |
| A�� | ���ʯ��ʯī | B�� | ${\;}_{8}^{16}$O��${\;}_{8}^{18}$O | ||
| C�� | CH3COOH��HCOOCH3 | D�� | C2H6��C3H8 |