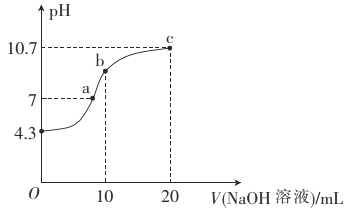
题目内容
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___________,步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________。
(2)步骤④的离子方程式是_______________。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)____________。
【答案】玻璃棒、烧杯、漏斗 冷却结晶、过滤、洗涤、干燥 Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 防止Fe2+被氧化 1: 4 硫酸亚铁在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液
Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液 ![]() ×100%
×100%
【解析】
废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2xH2O,过滤,滤渣为TiO2xH2O、Fe,滤液为FeSO4;FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加如碳酸氢铵,反应生成碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸,碳酸亚铁溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体。
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作为过滤,过滤用的仪器有玻璃棒、烧杯、漏斗;步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:玻璃棒、烧杯、漏斗;冷却结晶、过滤、洗涤、干燥;
(2)步骤④的反应为FeSO4与如碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵和二氧化碳,反应的离子方程式是Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑;
(3)Fe2+具有还原性,步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及隔绝空气,防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,反应的方程式为4FeSO4+ O2 ![]() 4SO3+ 2 Fe2O3,由化合价变化可知,氧化剂为O2和还原剂为FeSO4,由得失电子数目守恒可知氧化剂和还原剂的物质的量之比为1: 4,故答案为:1:4;
4SO3+ 2 Fe2O3,由化合价变化可知,氧化剂为O2和还原剂为FeSO4,由得失电子数目守恒可知氧化剂和还原剂的物质的量之比为1: 4,故答案为:1:4;
(5)硫酸亚铁在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),加入乳酸,CO32-与乳酸反应,使CO32-浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,故答案为:硫酸亚铁在溶液中存在如下平衡FeCO3(s)
Fe2+(aq)+ CO32-(aq),加入乳酸,CO32-与乳酸反应,使CO32-浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,故答案为:硫酸亚铁在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
Fe2+(aq)+ CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(6)亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据得失电子守恒可知5FeSO4·7H2O—KMnO4,则依据消耗0.1000mol/LKMnO4溶液20.00mL可知FeSO4·7H2O的质量分数为![]() ×100% =
×100% =![]() ×100%,故答案为:
×100%,故答案为:![]() 。
。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X原子的L层电子数是K层电子数的2倍 |
Y | Y原子的最外层电子排布式为:nsnnpn+2 |
Z | Z存在质量数为23,中子数为12的原子核 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第_____周期第______族,其原子最外层有____个电子。
(2)X的活泼性比Y的_____(填“强”或“弱”);X和Y的气态氢化物中,较稳定的是____(写化学式)。
(3)写出Z2Y2的电子式________________,XY2的结构式__________________。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称______________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式________________。