题目内容
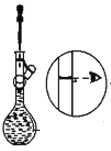
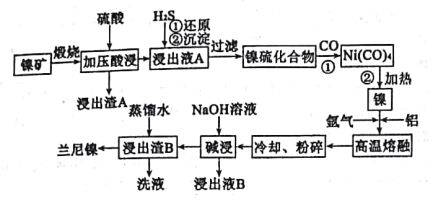
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL0.2 molL-1的稀硫酸。可供选用的仪器有:①托盘天平;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。

(1)配制稀硫酸时,还缺少的仪器有________________(写仪器名称),
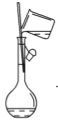
(2)下图是某些仪器的刻度部分示意图,其中为量筒的是________(填编号)。配制稀硫酸需要用量筒量取上述浓硫酸的体积为________mL,量取硫酸时应选用________(填选项)规格的量筒。
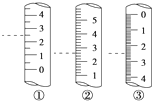
A.10mL B.50mL C.100mL D.200mL
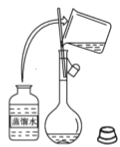
(3)下图为量取浓硫酸后配制稀硫酸的操作示意图,其正确的操作步骤为_______(填编号)。
|
|
|
|
|
|
① | ② | ③ | ④ | ⑤ | ⑥ |
(4)对所配制的稀硫酸进行测定,发现其浓度大于0.2 mol/L,引起该误差的原因可能是_____。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
D.将稀释后的稀硫酸未冷却立即转入容量瓶后,紧接着就进行以后的实验操作
E.定容时,俯视容量瓶刻度线进行定容
【答案】胶头滴管、500mL容量瓶 ② 5.4 A ⑤②⑥④①③ BDE
【解析】
(1)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器和缺少的仪器;
(2)根据量筒的构造分析判断;先计算出浓硫酸的物质的量浓度,再根据溶液稀释定律c浓V浓=c稀V稀来计算;根据“大而近”的原则选择合适的量筒;
(3)根据配制一定物质的量浓度的溶液的配制步骤排序;
(4)根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
(1)配制一定物质的量浓度的溶液的步骤为:计算、量取、溶解、冷却、转移、洗涤、定容、摇匀等,使用的仪器为:量筒、烧杯、玻璃棒、胶头滴管、容量瓶,配制480mL 0.2mol/L的稀硫酸,应选择500mL容量瓶,所以还缺少的仪器:胶头滴管;500mL容量瓶,故答案为胶头滴管、500mL容量瓶;
(2)量筒的刻度是从下而上标注的,而且没有0刻度,因此②为量筒;浓硫酸的物质的量浓度为c=![]() =
=![]() =18.4mol/L,设所需的浓硫酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可知:18.4mol/L×VmL=0.2mol/L×500mL,解得V=5.4mL,故应选择10mL量筒,故答案为②;5.4;A;
=18.4mol/L,设所需的浓硫酸的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可知:18.4mol/L×VmL=0.2mol/L×500mL,解得V=5.4mL,故应选择10mL量筒,故答案为②;5.4;A;
(3)配制一定物质的量浓度的溶液的步骤为:计算、量取、溶解、冷却、转移、洗涤、定容、摇匀等,因此量取浓硫酸后配制稀硫酸的操作顺序为⑤②⑥④①③,故答案为⑤②⑥④①③;
(4)A.所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸被稀释浓度减小,则配制的溶液浓度偏低,故A不选;B.用量筒量取浓硫酸时,仰视刻度线,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故B选;C.容量瓶用蒸馏水洗涤后未经干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;D.将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作,冷却后溶液体积偏小,溶液浓度偏高,故D选;E.定容时,俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故E选;故答案为BDE。

 阅读快车系列答案
阅读快车系列答案