题目内容
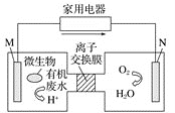
【题目】以某镍矿(主要成分为NiS、CuS、FeS、SiO2等)为原料制备一种多孔结构的细小镍晶粒,可用作有机物氢化反应的催化剂和储氢材料。工艺流程如图所示:[已知金属活动顺序为:Fe>Ni>(H)>Cu]
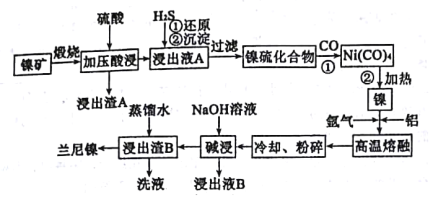
(1)已知该镍矿煅烧后生成Ni2O3,而加压酸浸液A中含有Ni2+,写出有关镍元素的加压酸浸的化学方程式___。
(2)已知Ni(CO)4的沸点是42.2℃,Ni(S)+4CO(g)![]() Ni(CO)4(g)的平衡常数与温度的关系如下:
Ni(CO)4(g)的平衡常数与温度的关系如下:

步骤①、步骤②的最佳温度分别是___、___(填选项代号)
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(3)“高温熔融”时通入氩气的目的是___。
(4)“碱浸”是整个流程的核心步骤,该步骤的目的是___,发生反应的离子方程式为___。
(5)浸出液B可以回收,重新生成铝以便循环利用,请设计简单的回收流程:
(示例:![]() )浸出液B→___。
)浸出液B→___。
(6)镍硫化合物中会含有少量的CuS,也可以采用电解精炼的方法获得纯镍,流程为:
![]()
电解制粗镍时阳极发生的主要电极反应式为___;
精炼过程需控制pH2~5的原因___。
【答案】2Ni2O3+4H2SO4=4NaSO4+O2↑+4H2O C E 防止Ni、Al被空气中的氧气氧化 除去合金中的铝,形成多孔结构,便于吸附氢气 2Al+2OH-+2H2O=2AlO2-+3H2↑ B→Al(OH)3→Al2O3→Al(反应条件:第一步CO2;第二步:灼烧;第三步:电解) NiS-2e-=Ni2++S 当pH<2时,c(H+)大,易在阳极放电,当pH>5时,c(OH-)大,Ni2+易生成Ni(OH)2沉淀
【解析】
镍矿(主要成分为NiS、CuS、FeS和SiO2等)煅烧发生氧化还原反应得到Ni2O3、、CuO、Fe2O3(SiO2不反应),加入硫酸加压酸浸,Ni2O3、CuO、Fe2O3溶解, SiO2不与硫酸反应,过滤得到浸出渣A(SiO2),浸出液A中含Ni2+、Cu2+、Fe3+,向浸出液A中通入H2S气体,还原Fe3+为Fe2+,并得到含有少量硫化铜的NiS沉淀,过滤得到镍硫化合物,再通入CO气体,形成Ni(CO)4,加热得到镍,高温熔融时通入氩气,加入铝,得到合金,将合金冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,浸出液B中含偏铝酸根,最后用蒸馏水洗浸出渣B,得到产品兰尼镍,据此分析解答。
(1)加压酸浸液A中含有Ni2+,说明加压酸浸过程中Ni元素被还原,参与反应的物质有Ni2O3,H2SO4,可能有水,根据各元素的价态规律可知只有O元素能被氧化,所以氧化产物为O2,根据电子守恒和元素守恒可得方程式为2Ni2O3+4H2SO4=4NaSO4+O2↑+4H2O;
(2)平衡常数越大正反应进行的越彻底,步骤①要得到Ni(CO)4,需要平衡右移,据表格可知温度越低平衡常数越大,但考虑到Ni(CO)4的沸点是42.2℃,且气体与气体反应接触面积更大,反应速率更快,所以步骤①最合适的温度为50℃,即选C;步骤②需要平衡逆向移动,则需要适当提高温度,所以步骤②的最佳温度为230℃,即选E;
(3)氩气性质稳定,通入氩气可防止Ni、Al被空气中的氧气氧化;
(4)根据分析可知碱浸的主要目的,除去合金中的铝,形成多孔结构,便于吸附氢气;离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)浸出液B中Al元素的主要存在形式为AlO2-,为得到单质铝,可先通入二氧化碳得到氢氧化铝沉淀,灼烧沉淀生成氧化铝,电解熔融氧化铝得到铝单质;
(6)电解池中阳极发生氧化反应,粗镍中S2-还原性最强,优先被氧化生S单质,所以主要反应为NiS-2e-=Ni2++S;Ni的活泼性比氢强,所以当pH<2时,c(H+)大,易在阳极放电生成氢气,当pH>5时,c(OH-)大,Ni2+易生成Ni(OH)2沉淀,所以精炼过程需控制pH为2~5。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | G | H | J | |||
3 | B | C | D | I |
根据A-J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是_________________,氧化性最强的单质是___________。
(2)常温常压下,1g A单质完全燃烧生成液态水时放出的热量为Q kJ,写出该反应的热化学方程式______________。
(3)B、G、I简单离子半径由大到小的顺序是____________。
(4)A、G、I形成有漂白性的化合物的电子式是___________。
(5)由A、F、G、H四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的化学方程式是___________________。
(6)B最高价氧化物对应的水化物与D最高价氧化物对应的水化物反应的离子方程式是_______。
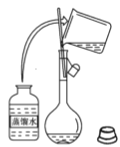
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL0.2 molL-1的稀硫酸。可供选用的仪器有:①托盘天平;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。

(1)配制稀硫酸时,还缺少的仪器有________________(写仪器名称),
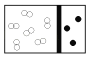
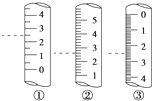
(2)下图是某些仪器的刻度部分示意图,其中为量筒的是________(填编号)。配制稀硫酸需要用量筒量取上述浓硫酸的体积为________mL,量取硫酸时应选用________(填选项)规格的量筒。
A.10mL B.50mL C.100mL D.200mL
(3)下图为量取浓硫酸后配制稀硫酸的操作示意图,其正确的操作步骤为_______(填编号)。
|
|
|
|
|
|
① | ② | ③ | ④ | ⑤ | ⑥ |
(4)对所配制的稀硫酸进行测定,发现其浓度大于0.2 mol/L,引起该误差的原因可能是_____。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
D.将稀释后的稀硫酸未冷却立即转入容量瓶后,紧接着就进行以后的实验操作
E.定容时,俯视容量瓶刻度线进行定容