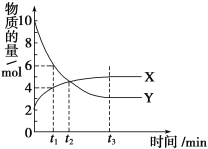
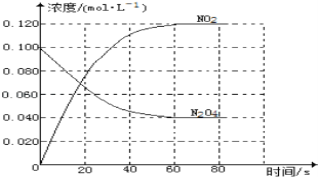
题目内容
【题目】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为_____,B在周期表中的位置____。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146g·mol-1,该物质的化学式为___。已知DBn 在温度高于45度时为气态。DBn属于____晶体。
(3)C与氢元素组成1:1的化合物,与水发生剧烈反应生成一种气体,写出该反应化学反应方程式_______。
(4)D元素的+4价含氧酸钠盐,该钠盐在空气中容易变质,设计实验方案证明该盐已经变质____。
【答案】氨气(电子式) 第二周期第ⅦA族 SF6 分子 NaH+H2O=NaOH+H2↑ 取少量该钠盐溶于水,加入足量,再加入少量BaCl2溶液,若有白色沉淀产生,则说明已经变质
【解析】
根据元素性质及核外电子排布规律分析元素的种类;根据题干信息及物质性质书写反应方程式;根据常见离子检验方法设计实验方案。
A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,则A为氮;B为最活泼的非金属元素,则B为氟;C元素的原子的电子层数是最外层电子数的3倍,则C为钠;D元素最高化合价为+6价,则D为硫;
(1)A元素气态氢化物为氨气,属于共价化合物,其电子式为![]() ;氟原子有9个电子,一共有2个电子层,最外层电子数为7,所以在周期表中的位置为第二周期第ⅦA族;
;氟原子有9个电子,一共有2个电子层,最外层电子数为7,所以在周期表中的位置为第二周期第ⅦA族;
(2)硫元素最高化合价为+6价,氟元素最低负价为-1,又因为SFn的摩尔质量为146g·mol-1,则该物质的化学式为SF6;SF6的沸点比较低,所以SF6属于分子晶体;
(3)钠与氢元素组成1:1的化合物为NaH,与水发生剧烈反应生成氢气,该反应化学反应方程式NaH+H2O=NaOH+H2↑;
(4)硫元素的+4价含氧酸钠盐为Na2SO3,亚硫酸根容易被氧气氧化为硫酸根,所以检验该钠盐在空气是否已经变质,只要检验钙盐中是否存在硫酸根,实验方案为:取少量该钠盐溶于水,加入足量,再加入少量BaCl2溶液,若有白色沉淀产生,则说明已经变质。

【题目】某学习小组查阅资料加。大多数硝酸盐不稳定。受热易分解,分解产物与金属活动顺序有关)了探究硝酸铁分解产物。他们进行如下探究:
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是_______;根据氧化还原反应原理,不成立的猜想还有__________
[查阅资料]
①几种气体熔点。沸点如下:
气体 | NO | NO2 | O2 |
熔点/℃ | -163.6 | -11.2 | |
沸点/℃ | -151 | 21.1 | -183 |
②2NO2(g) ![]() N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U型管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是___________
(3)实验完毕,取出U型管,打开塞子。观察到有棕色气体产生,则U型管内的气体是_____
向U型管加入_____能吸收该物质。避免污染环境。
(4)检验B瓶收集气体为氧气的操作方法是__________
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
步骤 | 现象 | |
甲 | 取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液 | 溶液无明显颜色变化 |
乙 | 取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液 | 溶液变红色 |
(5)上述实验,不能确定固体成分的实验是______(填“甲”或“乙”);根据上迷实验结论。写出硝酸铁分解反应的化学方程式______________