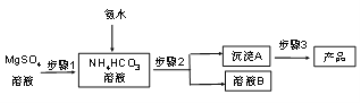
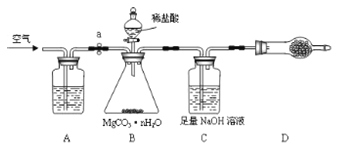
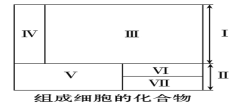
题目内容
【题目】A、B、C、D是四中短周期元素,原子序数依次增大,且只有C为金属元素,A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等,请回答下列问题:
(1)D元素在元素周期表中的位置____________,写出实验室制取D单质的化学方程式_____________。
(2)A、B、C形成的化合物所含化学键类型___________________。
(3)用电子式表示C、D构成化合物形成过程______________
(4)由元素B和D形成的单质或化合物能用于自来水消毒的是_________、_________。
【答案】(1)第三周期第ⅦA族 (1分,有错不给分)MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)离子键、共价键 (1分,只答出一种不给分)
(3)![]() ;
;
(4)O3、Cl2、ClO2中两种即给分。
【解析】试题分析:短周期元素A、B、C、D原子序数依次增大,B的最外层电子数是次外层的3倍,最外层电子数不超过8个,则次外层为K层,则B为O元素;B、C的最外层电子数之和与D的最外层电子数相等,B的最外层电子数为6,D为短周期元素,如果D是Cl元素,则C是Na元素,A、C是同一主族,则A是H元素;如果D是Ar元素,则C是Mg原子,A、C是同一主族,A为Be元素,不符合只有C是金属元素条件,故舍去;所以A、B、C、D分别是H、O、Na、Cl元素。(1)D是Cl元素。主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数,Cl原子核外有3个电子层、最外层电子数是7,所以位于第三周期第VIIA族;在实验室是用浓盐酸与MnO2混合加热的方法制取氯气,反应的方程式是:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;(2)A、B、C三种元素组成的常见化合物NaOH,该化合物是离子化合物,含有离子键、极性共价键;(3)C、D构成化合物是NaCl,用电子式表示该化合物形成过程是
MnCl2+2H2O+Cl2↑;(2)A、B、C三种元素组成的常见化合物NaOH,该化合物是离子化合物,含有离子键、极性共价键;(3)C、D构成化合物是NaCl,用电子式表示该化合物形成过程是![]() ;(4)由元素B和D形成的单质或化合物能用于自来水消毒的是O3、Cl2、ClO2等。
;(4)由元素B和D形成的单质或化合物能用于自来水消毒的是O3、Cl2、ClO2等。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案