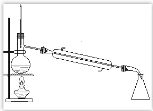
题目内容
【题目】高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入![]() 溶液的方法制备
溶液的方法制备![]() ,发生反应:
,发生反应:
①![]() (未配平);
(未配平);
②![]() 。
。
下列说法正确的是
A.若反应①中![]() ,则氧化剂与还原剂的物质的量之比为2:1
,则氧化剂与还原剂的物质的量之比为2:1
B.反应①中每消耗4 mol KOH,吸收标准状况下![]()
C.氧化性:![]()
D.若反应①的氧化产物只有KClO,则得到![]() 时消耗
时消耗![]()
【答案】D
【解析】
本题考查氧化还原反应,意在考查对相关规律的理解和运用能力。
A. 设ClO-为5 mol,ClO3-为1 mol,根据电子守恒,生成的Cl-为10 mol,故氧化剂与还原剂的物质的量之比为5:3,故A错误;
B.由于反应①的生成物有KCl、KClO、KClO3,其中K、Cl的物质的量之比为1:1,所以每消耗4 mol KOH,吸收2molCl2,标准状况下其体积为44.8 L,故B错误;
C.反应②中K2FeO4是氧化产物,KClO是氧化剂,故氧化性:K2FeO4<KClO,故C错误;
D.根据得失电子守恒可得关系式2 K2FeO4~3KClO~3Cl2,故D正确;
答案:D

练习册系列答案
相关题目