题目内容
【题目】过氧化氢分解反应过程中,能量变化如图所示:下列说法正确的是

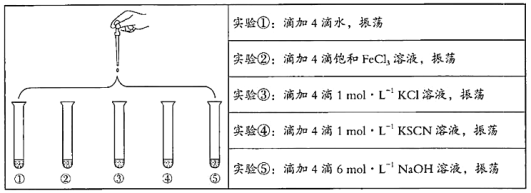
A. 催化剂可以改变过氧化氢分解反应的焓变
B. CuCl2或FeCl3可以催化H2O2分解反应
C. 催化剂不能改变反应路径
D. H2O2分解是吸热反应
【答案】B
【解析】
A.催化剂不能改变反应的焓变;
B. CuCl2或FeCl3是H2O2分解反应的催化剂;
C.催化剂能够降低化学反应的活化能,改变了反应路径;
D.由图可知,H2O2分解是放热反应;
A.反应的焓变,只与反应的始态和终态有关,而与变化路径无关,催化剂能降低反应所需的活化能,但不能改变反应的焓变,故A项错误;
B.CuCl2或FeCl3、过氧化氢酶等都可以催化H2O2分解反应,故B项正确;
C.由图可知,催化剂通过改变反应的途径降低了反应的活化能,故C项错误;
D.由坐标图可知,过氧化氢分解的反应中,反应物的总能量高于生成物的总能量,该反应为放热反应,故D项错误;
综上,本题选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题:
(1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2,搅拌并加热,发生反应:3I2+6NaOH![]() 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
(2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3-,且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸
实验操作 | 实验现象 | 结论 |
①用玻璃棒蘸取溶液,点在___试纸上 | 试纸呈蓝色 | c(OH-)>c(H+) |
②用玻璃棒蘸取溶液,点在___试纸上 | 试纸不变色 | |
③向实验②的试纸上滴加____溶液 | 试纸呈蓝色 | 溶液中有IO3- |
(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为___________。充分反应后,从混合物中获得NaI固体,首先应进行___________(填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是___________。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于___________g(精确到小数点后两位)。