题目内容
【题目】Ⅰ.⑴指出如下图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
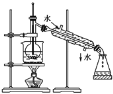
①____________________;
②____________________。
⑵图是某学生的过滤操作示意图,其操作不规范的是______

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:


⑴指出提取碘的过程中有关实验操作①和②的名称:__________;________。
⑵在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是上图中的_____(注:试管中深色区为有色溶液),上层无色溶液的溶质是_____下层颜色是_____。
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是_______。
Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

欲证明滤液中存在SO42-、OH-,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH-,均存在。
【答案】冷凝水下进上出 温度计水银球伸入液面下 ade 过滤 萃取分液 D KCl 紫红色 蒸馏 酚酞 BaCl2
【解析】
Ⅰ.(1)蒸馏时温度计测定馏分的温度、冷却水下进上出;
(2)过滤时遵循一贴二低三靠,以此来解答。
Ⅱ.海藻灼烧得到海藻灰,浸泡得到悬浊液,过滤得到含I-离子的溶液通入氯气,氧化碘离子为碘单质,加入四氯化碳萃取剂分液,得到含碘单质的四氯化碳溶液,从有机溶液中提取碘,需要蒸馏操作。
Ⅲ.滴加酚酞变红可检验OH-,再加盐酸酸化,然后加氯化钡检验硫酸根离子;
Ⅰ.(1)图1实验装置中的错误之处为:温度计的水银球未在支管口处、冷却水未下进上出;
(2)a.漏斗末端颈尖未紧靠烧杯壁,会引起液体飞溅,故a错误;
b.玻璃棒用作引流可使液体流下,操作合理,故正确;
c.将滤纸湿润,使其紧贴漏斗壁,防止漏液,操作合理,故正确;
d.滤纸边缘应低于漏斗的边缘,故错误;
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度,可能将滤纸捅破,故错误。
故选 ade。
Ⅱ.(1)海藻灼烧得到海藻灰,浸泡得到悬浊液,过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,过滤得到含I-离子的溶液通入氯气,氧化碘离子为碘单质,将碘水中的碘单质萃取出来,选择合适的萃取剂即可,加入四氯化碳萃取剂分液,得到含碘单质的四氯化碳溶液,从有机溶液中提取碘,①和②的名称:过滤;萃取分液。
(2)在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象,上层是水层,3mL,呈无色,下层1mL是有机层,呈紫红色,故选上图中的D,上层无色溶液的溶质是KCl,下层颜色是紫红色。
(3)从含碘的有机溶液中提取碘和回收有机溶剂,利用沸点不同,还需经过的操作是蒸馏。
Ⅲ.欲证明滤液中存在SO42-、OH-,选用的方案是先取少量的滤液滴加酚酞,发现溶液变红,再向其中加入盐酸、氯化钡溶液,出现白色沉淀,则可证明SO42-、OH- 均存在。

【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+ H2O(g)═CO(g)+3H2(g) ΔH。
已知:①CH4、H2、CO的燃烧热分别为a ![]() 、b
、b ![]() 、c
、c ![]() (a、b、c均大于0);
(a、b、c均大于0);
②水的汽化热为+d ![]() (d >0)。则ΔH=__________
(d >0)。则ΔH=__________![]() (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(2)用合成气制甲醇的反应为2H2(g)+CO(g)![]() CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。
CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。

①ΔH________(填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO的转化率的措施:_______、_____。
③下列说法正确的是___________(填序号)。
A.温度越高,该反应的平衡常数越大
B.达平衡后再充入稀有气体,CO的转化率提高
C.体系内气体压强不再变化时,反应达到平衡状态
D.图中压强p1<p2
④200 ℃时,n(H2)随时间的变化如表所示,3 min时反应刚好达到平衡状态,请利用表中的数据计算0~3 min内v(CH3OH)=_______![]() 。
。
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
⑤200℃时该反应的平衡常数K=____________。向上述200 ℃的平衡体系中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则平衡_______(填“正向移动”“逆向移动”或“不移动”)。
(3)甲、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷时,测得电路中转移1.96 mol电子,则甲烷的利用率为________。


