题目内容
【题目】碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题:
(1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2,搅拌并加热,发生反应:3I2+6NaOH![]() 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
(2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3-,且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸
实验操作 | 实验现象 | 结论 |
①用玻璃棒蘸取溶液,点在___试纸上 | 试纸呈蓝色 | c(OH-)>c(H+) |
②用玻璃棒蘸取溶液,点在___试纸上 | 试纸不变色 | |
③向实验②的试纸上滴加____溶液 | 试纸呈蓝色 | 溶液中有IO3- |
(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为___________。充分反应后,从混合物中获得NaI固体,首先应进行___________(填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是___________。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于___________g(精确到小数点后两位)。
【答案】水浴加热 I2挥发,原料利用率低 红色石蕊 淀粉KI 1mol/LH2SO4 2Fe+IO3-+3H2O=2Fe(OH)3+I- 过滤 NaI在加热过程中,容易被氧气氧化(或混有过量氢氧化钠,合理即可) 3.73
【解析】
(1)水浴加热能很好的控制温度,所以最佳的加热方法为水浴加热,温度过高时I2挥发,原料利用率低。
(2)要检验反应后的溶液中存在碘酸根离子且溶液为碱性,可以利用碱性溶液中红色石蕊试纸变蓝,和碘酸根离子在酸性条件下和碘化钾反应生成碘单质遇到淀粉显蓝色进行检验。①检验碱性溶液应使用红色石蕊;②在碱性溶液中碘酸根离子和碘离子不会反应生成碘单质,所以先加入碘化钾淀粉试纸,试纸不变蓝,加入硫酸后试纸变蓝,所以步骤②中加入的为淀粉KI,步骤③加入的为1mol/LH2SO4。
(3)反应后的溶液中含有碘酸根离子,具有氧化性,可以将铁氧化为铁离子,在碱性条件下生成红褐色氢氧化铁沉淀,离子方程式为:2Fe+IO3- +3H2O=2Fe(OH)3+I-;反应后的混合物应先过滤除去氢氧化铁沉淀,得到碘化钠溶液,可能含有过量的氢氧化钠,若直接蒸发结晶可能应为含有氢氧化钠而使固体不纯,或因为NaI在加热过程中,容易被氧气氧化。25.4gI2的物质的量为0.1mol,反应最多能生成碘酸钠的物质的量为0.1/3 mol,碘酸根离子和铁反应时根据电子守恒分析,碘酸根离子得到的电子为0.2mol,则铁的物质的量为0.2/3 mol,则铁的质量为![]() g= 3.73g。
g= 3.73g。

 名校课堂系列答案
名校课堂系列答案【题目】“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)![]() CH3OH(g)的ΔH=_____ kJ·mol-1。
CH3OH(g)的ΔH=_____ kJ·mol-1。
(2)向2L恒容密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________。

(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
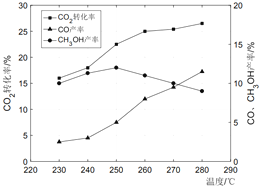
①由图可知温度升高CO产率上升,其主要原因是_____。
②由图可知获取甲醇最适宜的温度是_____。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0L,若CO2初始加入量为2.0mol,则反应I的平衡常数是_____。
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_____(填“正”或“负”)极,阳极电极反应式是_____。



