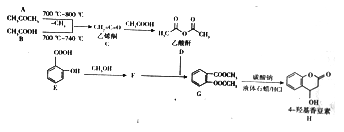
题目内容
【题目】能源是人类生存与发展比不可缺的,甲醇、甲醚(CH3OCH3)均是“清洁能源”,工业上可以通过多种方法合成它们。
(1)以CO、H2为原料合成甲醚的过程中,在反应器中发生了下列反应:
a.CO(g)+2H2(g)![]() CH3OH(g) △H=- 90kJ mol-1
CH3OH(g) △H=- 90kJ mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23 kJ mol-1
CH3OCH3(g)+H2O(g) △H=-23 kJ mol-1
c.CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ mol-1
CO2(g)+H2(g) △H=-41 kJ mol-1
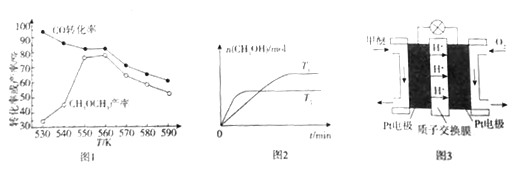
①选取适当的催化剂,在一定压强下,向某恒容密闭容器中通入H2和CO制备甲醚,测得的有关数据如图1所示。则制备甲醚时较适宜的生产温度范围是____________,通过理论分析得知反应c的存在能提高甲醚的产率,原因是________________________________________________。
②3CO(g)+3H2(g)![]() CH3OCH3(g)+ CO2(g) △H,则△H=____________。
CH3OCH3(g)+ CO2(g) △H,则△H=____________。
(2)用下列反应也可得到甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,v正____________ v逆(填“>”、“ <”或“=”)。
CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,v正____________ v逆(填“>”、“ <”或“=”)。
(3)控制适当的条件,CO2与H2也可转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
①该反应的△H____________0(填“>”、 “=”、“ <”,下同)
②若温度T1对应的化学平衡常数K1=10,则温度T2对应的化学平衡常数K2____________10。
③下列数据能说明该反应一定处于平衡状态的是____________(填选项字母)。
A.气体密度保持不变 B.n(H2)=0.3mol
C.CO2、H2的消耗速率比为1∶3 D.气体的平均相对分子质量保持不变
(4)图3为某绿色燃料电池的工作原理示意图,写出电池工作时负极上的电极反应式:______________。
【答案】 550 K560 K 反应c消耗了反应b中生成的水,有利于反应b向右进行 -244 kJ mol-1 < < < D CH3OCH3+3H2O-12e-=2CO2 +12H+
【解析】(1)①从图上数据可知,在550 K560 K之间甲醚的产率是最高的,所以制备甲醚时较适宜的生产温度范围是550 K560 K。反应c中CO消耗了反应b中生成的水,有效减小了反应b的混合体系中水的浓度,有利于反应b向右进行。
②a![]() 得总反应,3CO(g)+3H2(g)
得总反应,3CO(g)+3H2(g)![]() CH3OCH3(g)+ CO2(g) ,所以
CH3OCH3(g)+ CO2(g) ,所以
△H=2![]() = -244 kJ mol-1。
= -244 kJ mol-1。
(2)用下列反应也可得到甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,Qc=
CH3OCH3(g)+3H2O(g)。已知TK时,该反应的化学平衡常数K=1。则在相同温度下,当一恒容密闭容器中c(CO2)=2.0×10-2mol·L-1、c(H2)=1.0×10-2mol·L-1、c(CH3OCH3)=1.0×10-4mol·L-1、c(H2O)=2.0×10-4mol·L-1时,Qc=![]() =2>1,反应将向逆反应进行,所以 v正< v逆。
=2>1,反应将向逆反应进行,所以 v正< v逆。
(3)控制适当的条件,CO2与H2也可转化为甲醇:CO2(g)+H2(g)![]() CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
CH3OH(g)+H2O(g)。将CO2、H2按物质的量比为1∶3的比例加入到恒容密闭容器中反应。测得容器中n(CH3OH)在不同温度下随着时间的变化情况如图2所示.
①由图像可知,T2先达到化学平衡状态,但此温度下甲醇的平衡量较小,因为温度越高化学反应速率越大,所以T2>T1。因为温度升高化学平衡向吸热反应方向移动,所以该反应的△H<0。②对于放热反应,温度越高,其化学平衡常数就越小,所以若温度T1对应的化学平衡常数K1=10,则温度T2对应的化学平衡常数K2< 10。
③判断可逆反应是否达到化学平衡状态,可以根据正反应速率等于逆反应速率或体系中某变量不变来作出判断。由于正反应是气体分子数减少的反应,所以随正反应的发生,混合气体的平均相对分子质量减小,因此,气体的平均相对分子质量保持不变能说明该反应一定处于平衡状态。如果是恒恒温恒容,则密度是恒量;氢气的平衡量不可能是某个不变的数据,所以A和B不是;C中两个速率都是正反应速率,不能说明正反应速率和逆反应速率相等,所以C不是。
(4)由图3可知,该燃料电池中甲醚是还原剂,氧气是氧化剂,电池中使用了质子交换膜,说明电解质是酸性的,所以甲醚被氧化成二氧化碳和水,电池工作时负极上的电极反应式为CH3OCH3+3H2O-12e-=2CO2 +12H+。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案