题目内容
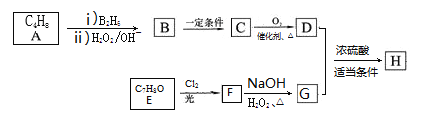
【题目】有机物H[![]() ]是一种重要的液晶材料,工业上合成它的一种路线如下图所示,其中A是不饱和烃,E的苯环上的有2种不同化学环境的氢原子。
]是一种重要的液晶材料,工业上合成它的一种路线如下图所示,其中A是不饱和烃,E的苯环上的有2种不同化学环境的氢原子。
已知:①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②一个碳原子上连接有2个-OH时会自动脱去一个水分子形成一个碳氧双键。
(1)H中官能团的名称为____________,E→F的反应类型为____________。
(2)A的名称是____________,E的结构简式为____________ ,B→C中的“一定条件”内容是____________。
(3)F→G的化学方程式为____________。
(4)C还有多种同分异构体,写出其含有碳氧双键的同分异构体的结构简式:____________。
(5)现代物理方法中,能用于区分C、D两种物质的方法是____________(写出一种即可)。
(6)以1—苯基乙醇( )为基本原料制取苯乙醛,仿照C转化为D的形式,表示出合成路线图:_____________________________________________________________。
)为基本原料制取苯乙醛,仿照C转化为D的形式,表示出合成路线图:_____________________________________________________________。
【答案】 酯基、醛基 取代反应 2—甲基丙烯(或甲基丙烯) ![]() 氧气、催化剂、加热
氧气、催化剂、加热 ![]() CH3CH2CH2CHO、CH3CH2COCH3 红外光谱或核磁共振氢谱或质谱法
CH3CH2CH2CHO、CH3CH2COCH3 红外光谱或核磁共振氢谱或质谱法 
![]()
【解析】E的苯环上的有2种不同化学环境的氢原子,分子式为C7H8O,所以E为对甲基苯酚。其与氯气在光照条件下发生的是苯环侧链上的取代,由H的结构结合信息②一个碳原子上连接有2个-OH时会自动脱去一个水分子形成一个碳氧双键,可以推知E发生的是二氯取代得F,F在氢氧化钠水溶液中水解得到G对羟基苯甲醛。再由G和H结合反应条件逆推出D为2-甲基丙酸,C为2-甲基丙醛,B为2-甲基-1-丙醇,最后由B结合信息①推出A为2-甲基丙烯。
(1). H中官能团的名称为酯基、醛基,E→F的反应类型为取代反应。
(2). A的名称是2—甲基丙烯(或甲基丙烯),E的结构简式为![]() ,B→C发生的是醇的催化氧化,氧化剂是氧气,可以用铜或银作催化剂,还需要加热条件,所以“一定条件”内容是“氧气、催化剂、加热”。
,B→C发生的是醇的催化氧化,氧化剂是氧气,可以用铜或银作催化剂,还需要加热条件,所以“一定条件”内容是“氧气、催化剂、加热”。
(3). F→G发生了多个反应:酚羟基与碱反应、氯代烃水解、同一碳原子上连接2个-OH自动脱去一个水分子的反应,总化学方程式为如下:![]() 。 (4). C还有多种同分异构体,其中含有碳氧双键的同分异构体可以从碳链异构找到丁醛,从官能团异构找到丁酮,结构简式分别为CH3CH2CH2CHO、CH3CH2COCH3。
。 (4). C还有多种同分异构体,其中含有碳氧双键的同分异构体可以从碳链异构找到丁醛,从官能团异构找到丁酮,结构简式分别为CH3CH2CH2CHO、CH3CH2COCH3。
(5). 现代物理方法中,根据C和D的官能团不同可以用红外光谱法区别C和D;C和D虽然都有3种不同化学环境的H原子,但是因为它们的官能团不同,在核磁共振氢谱中的化学位移是不同的,所以根据核磁共振氢谱能区分C、D;还可以根据两者的相对分子质量不同用质谱法区别C和K这两种物质,在质谱图中,质荷比的最大值就是该物质的相对分子质量。
(6). 以1—苯基乙醇( )为基本原料制取苯乙醛,可以先用浓硫酸作催化剂和脱水剂加热条件下把1-苯基乙醇脱水生成苯乙烯,然后使用信息①把苯乙烯转化为苯乙醇,最后把苯乙醇催化氧化为苯乙醛,合成路线图如下:
)为基本原料制取苯乙醛,可以先用浓硫酸作催化剂和脱水剂加热条件下把1-苯基乙醇脱水生成苯乙烯,然后使用信息①把苯乙烯转化为苯乙醇,最后把苯乙醇催化氧化为苯乙醛,合成路线图如下:
![]() 。
。


