题目内容
11.下列各组顺序的排列错误的是( )| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性:HAlO2<H2SiO3<H2CO3<H3PO4 | D. | 熔点:金刚石>NaCl>Na>CO2 |
分析 A.核外电子排布相同时,核电荷数越大,半径越小;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强;
D.熔点的一般规律:原子晶体>离子晶体>分子晶体.
解答 解:A.核外电子排布相同时,核电荷数越大,半径越小,所以离子半径:F->Na+>Mg2+>Al3+,故A错误;
B.元素的非金属性越强,对应的氢化物越稳定,元素的非金属性:Cl>S>P>As,则热稳定性:HCl>H2S>PH3>AsH3,故B正确;
C.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强,元素的非金属性:P>C>Si>Al,则酸性:HAlO2<H2SiO3<H2CO3<H3PO4,故C正确;
D.熔点的一般规律:原子晶体>离子晶体>分子晶体,则熔点:金刚石>NaCl>Na>CO2,故D正确.
故选A.
点评 本题考查同主族、同周期元素性质递变规律、半径比较、物质性质等,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
1.有X、Y两种元素,原子序数≤20,X、Y原子的最外层电子数相同且离子半径X小于Y(选项中m、n均为正整数)下列说法正确的是( )
| A. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| B. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质也一定是Y2 | |
| D. | 若Y的最高正化合价为+m,则X的最高正化合价一定为+m |
2.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2.下列说法中错误的是( )
| A. | 工作时,负极上发生反应的物质是Zn | |
| B. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 工作时,负极区溶液氢氧根浓度减小 | |
| D. | 正极上发生的反应是Ag2O+H2O+2e-═2Ag+2OH- |
19.对于反应:2Na2O2+2CO2═2Na2CO3+O2,被氧化的氧原子与被还原的氧原子的个数之比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:2 |
6.环境问题是现在社会急需解决的问题,有报道说:现在全球癌症的发病率呈上升趋势.有消息称:${\;}_{67}^{166}Ho$可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
| A. | 67 | B. | 32 | C. | 99 | D. | 166 |
16.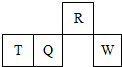 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物的水化物能与氨水反应 |
3.请你完成下表中1-8处的空白.
①98g/mol,②1mol,③18,④6.0201×1023,⑤17g/mol,⑥1mol,⑦56,⑧6.0200×1023.
| 物质及其质量 | 相对原子质量或相对分子质量 | 摩尔质量 | 物质的量 | 一个粒子的质量 | 所含粒子的数目 |
| 98gH2SO4 | 98 | ① | ② | 1.628×10-22g | 6.0197×1023 |
| 18gHN4+ | ③ | 18g/mol | l mol | 2.9900×10-23g | ④ |
| 17gOH- | 17 | ⑥ | ⑥ | 2.8239×10-23g | 6.0200×1023 |
| 56gFe | ⑦ | 56g/mol | l mol | 9.3023×10-23g | ⑧ |
1.已知3NaClO$\frac{\underline{\;\;△\;\;}}{\;}$2NaCl+NaClO3.在某温度下,向含2mol NaOH的溶液中通入适量氯气恰好完全反应.下列推断正确的是( )
| A. | 若产物中$\frac{n(NaClO)}{n(NaCl)}$=1,则在较低温度下反应,消耗22.4L氧气 | |
| B. | 若产物中$\frac{n(NaClO)}{n(NaCl{O}_{3})}$=1,则在较高温度下反应且生成1.5mol氯化钠 | |
| C. | 改变温度,理论上生成的氯酸钠的物质的量最多为0.5mol | |
| D. | 理论上,上述反应中转移电子最多为1mol |