题目内容
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加___溶液,溶液颜色无明显变化,由此可知样品中无Fe3+。
(2)为测定绿矾中结晶水含量,称石英玻璃管(带开关K1和K2)(设为装置A)的质量,记为m1g。将样品装入石英玻璃管中,再次称其质量,记为m2g。按如图连接好装置进行实验。
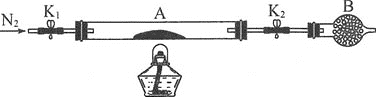
①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填字母);重复上述操作步骤,直至A质量不变,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式,结晶水数目x=___。若实验时按a、d次序操作,则使x___(填偏大偏小或无影响)。
(3)为探究硫酸亚铁的分解产物,将(2)中已质量不变的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
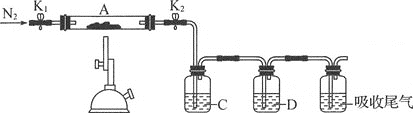
①C、D中的溶液依次为___(填字母),可观察到C、D中有气泡冒出。
a.品红 b.NaOH C.BaCl2 d.Ba(NO3 )2 e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式:___。
【答案】KSCN (球形)干燥管 dabfce ![]() 偏小 c、a 2FeSO4
偏小 c、a 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
(1)绿矾是FeSO4·7H2O,Fe2+与SCN-混合不显血红色,Fe3+与SCN-混合出现血红色,据此分析;
(2)①根据仪器的特点判断仪器的名称;
②实验时,为避免Fe2+被氧化,应先通入氮气,冷却水注意关闭开关,防止氧气的进入;
③加热绿矾,绿矾失去结晶水,即结晶水的质量为(m2-m3)g,FeSO4的质量为(m3-m1)g,a、d次序操作,造成FeSO4被氧化,据此分析;
(3)FeSO4高温分解可生成Fe2O3、SO2、SO3,C为BaCl2溶液,用于检验SO3,D为品红,用于检验SO2,据此分析。
(1)在试管中加入少量绿矾样品,加水溶解。滴加KSCN溶液,溶液颜色无明显变化,说明溶液中不存在铁离子;
(2)![]() 据图所示可知,仪器B的名称是:球形干燥管;
据图所示可知,仪器B的名称是:球形干燥管;
![]() 将下列实验操作步骤正确排序:打开
将下列实验操作步骤正确排序:打开![]() 和
和![]() ,缓缓通入
,缓缓通入![]() 以赶尽装置中的空气;点燃酒精灯,加热使绿矾失去结晶水;熄灭酒精灯停止实验;冷却至室温;关闭
以赶尽装置中的空气;点燃酒精灯,加热使绿矾失去结晶水;熄灭酒精灯停止实验;冷却至室温;关闭![]() 和
和![]() 防止水蒸气进入装置A内;称量A;故实验操作步骤正确排序为:dabfce;
防止水蒸气进入装置A内;称量A;故实验操作步骤正确排序为:dabfce;
![]() 根据实验记录,
根据实验记录,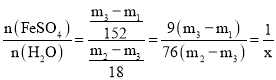 ,绿矾化学式中结晶水数目
,绿矾化学式中结晶水数目![]() ,若实验时按先点燃酒精灯加热,再打开
,若实验时按先点燃酒精灯加热,再打开![]() 和
和![]() ,则A中固体会与空气先反应,加热过程中硫酸亚铁被空气氧化为硫酸铁,导致
,则A中固体会与空气先反应,加热过程中硫酸亚铁被空气氧化为硫酸铁,导致![]() 增大,使x偏小;
增大,使x偏小;
(3)![]() 受热分解可产生二氧化硫或三氧化硫,实验C中的溶液氯化钡检验吸收是否有三氧化硫,不能用硝酸钡,因为能将二氧化硫氧化、D中的溶液为品红用来检验二氧化硫的存在;
受热分解可产生二氧化硫或三氧化硫,实验C中的溶液氯化钡检验吸收是否有三氧化硫,不能用硝酸钡,因为能将二氧化硫氧化、D中的溶液为品红用来检验二氧化硫的存在;
![]() 因为D中所盛的试剂为品红溶液,观察到溶液褪色,则说明产物中有二氧化硫和三氧化硫,根据氧化还原反应的原理,则生成物有氧化铁,所以硫酸亚铁高温分解反应的化学方程式:
因为D中所盛的试剂为品红溶液,观察到溶液褪色,则说明产物中有二氧化硫和三氧化硫,根据氧化还原反应的原理,则生成物有氧化铁,所以硫酸亚铁高温分解反应的化学方程式:![]() 。
。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
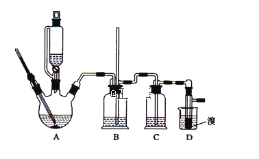
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
【题目】![]() 物质结构与性质
物质结构与性质![]() VA族元素单质及其化合物在工农业生产中有重要用途。回答下列问题:
VA族元素单质及其化合物在工农业生产中有重要用途。回答下列问题:
![]() 基态As原子的核外电子排布式为
基态As原子的核外电子排布式为![]() ________,有________个未成对电子。
________,有________个未成对电子。
![]() 元素周期表中,与P紧邻的4种元素中电负性最大的是________(填元素符号
元素周期表中,与P紧邻的4种元素中电负性最大的是________(填元素符号![]() 。Si、P、S三种元素的第一电离能由大到小的顺序是________。
。Si、P、S三种元素的第一电离能由大到小的顺序是________。
![]() 铵盐大多不稳定,
铵盐大多不稳定,![]() F、
F、![]() 中,较易分解的是________,原因是________。
中,较易分解的是________,原因是________。
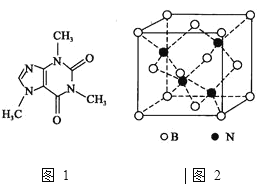
![]() 咖啡因对中枢神经有兴奋作用,其结构简式如图1。常温下,咖啡因在水中的溶解度为
咖啡因对中枢神经有兴奋作用,其结构简式如图1。常温下,咖啡因在水中的溶解度为![]() ,加适量水杨酸钠
,加适量水杨酸钠![]() 可使其溶解度增大,其原因可能是________,分子中氮原子的杂化类型有________。
可使其溶解度增大,其原因可能是________,分子中氮原子的杂化类型有________。
![]() 氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点 | 3000 | 2200 | 1700 |
![]() 试从结构的角度分析它们熔点不同的原因________。
试从结构的角度分析它们熔点不同的原因________。
![]() 的晶胞结构如图2所示,晶体中一个B原子周围距离最近的N原子有________个;若B、N的原子半径分别为
的晶胞结构如图2所示,晶体中一个B原子周围距离最近的N原子有________个;若B、N的原子半径分别为![]() 和
和![]() ,密度为
,密度为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则BN晶胞中原子的体积占晶胞体积的百分率为________。
,则BN晶胞中原子的体积占晶胞体积的百分率为________。
【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
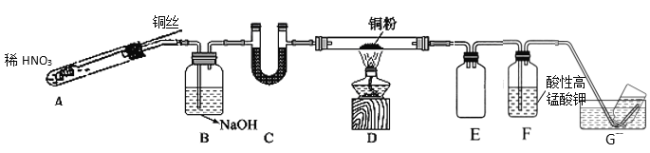
①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
【题目】一定温度下,向容积为2 L的密闭容器中充入一定量的气体A和气体B,发生反应: 2A(g)+B(g) ![]() 2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
反应时间/min | n(A)/mol | n(B)/mol |
0 | 0.10 | 0.060 |
t1 | 0.012 | |
t2 | 0.016 |
A.在0~t1 min内的平均反应速率为v(C)=![]() molL-1min-1
molL-1min-1
B.其他条件不变,起始时向容器中充入0.10 mol C和0.010 mol B,平衡时n(A)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(A)=0.0070 molL-1,则反应的ΔH<0
D.相同温度下,起始时向容器中充入0.15mol A和0.090mol B,平衡时A转化率小于88%