题目内容
【题目】![]() 物质结构与性质
物质结构与性质![]() VA族元素单质及其化合物在工农业生产中有重要用途。回答下列问题:
VA族元素单质及其化合物在工农业生产中有重要用途。回答下列问题:
![]() 基态As原子的核外电子排布式为
基态As原子的核外电子排布式为![]() ________,有________个未成对电子。
________,有________个未成对电子。
![]() 元素周期表中,与P紧邻的4种元素中电负性最大的是________(填元素符号
元素周期表中,与P紧邻的4种元素中电负性最大的是________(填元素符号![]() 。Si、P、S三种元素的第一电离能由大到小的顺序是________。
。Si、P、S三种元素的第一电离能由大到小的顺序是________。
![]() 铵盐大多不稳定,
铵盐大多不稳定,![]() F、
F、![]() 中,较易分解的是________,原因是________。
中,较易分解的是________,原因是________。
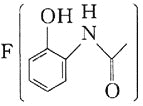
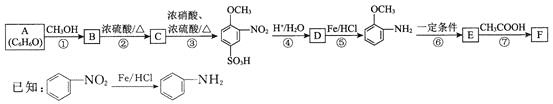
![]() 咖啡因对中枢神经有兴奋作用,其结构简式如图1。常温下,咖啡因在水中的溶解度为
咖啡因对中枢神经有兴奋作用,其结构简式如图1。常温下,咖啡因在水中的溶解度为![]() ,加适量水杨酸钠
,加适量水杨酸钠![]() 可使其溶解度增大,其原因可能是________,分子中氮原子的杂化类型有________。
可使其溶解度增大,其原因可能是________,分子中氮原子的杂化类型有________。
![]() 氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点 | 3000 | 2200 | 1700 |
![]() 试从结构的角度分析它们熔点不同的原因________。
试从结构的角度分析它们熔点不同的原因________。
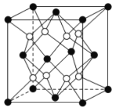
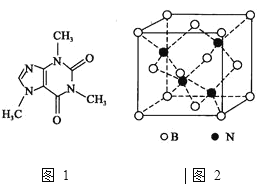
![]() 的晶胞结构如图2所示,晶体中一个B原子周围距离最近的N原子有________个;若B、N的原子半径分别为
的晶胞结构如图2所示,晶体中一个B原子周围距离最近的N原子有________个;若B、N的原子半径分别为![]() 和
和![]() ,密度为
,密度为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则BN晶胞中原子的体积占晶胞体积的百分率为________。
,则BN晶胞中原子的体积占晶胞体积的百分率为________。
【答案】![]() 3
3 ![]()
![]()
![]() F原子半径比I原子小,
F原子半径比I原子小,![]() 键比
键比![]() 键强
键强![]() 更易形成
更易形成![]() ,
,![]() 更易夺取
更易夺取![]() 中的
中的![]() 咖啡因与水杨酸钠形成了氢键
咖啡因与水杨酸钠形成了氢键 ![]() 和
和![]() 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低
氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低 ![]()
![]()
【解析】
(1)As是33号元素,位于第四周期第VA族,基态As原子核外电子排布式为[Ar]3d104s24p3,根据核外电子排布确定未成对电子;
(2)在元素周期表中,同周期中从左向右,元素的非金属性增强,电负性增强,同主族元素从上向下,元素的非金属性减弱,电负性减弱;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)分解的本质是X-离子夺取NH4+中的H,原子半径越小、电负性越大夺取能力越强;
(4)氢键的形成可对物质的某种性质造成影响,如熔沸点升高,溶解度增大等;可根据N原子形成的价键类型判断杂化方式,形成不饱和三键是sp杂化,形成不饱和双键是sp2杂化,形成饱和单键是sp3杂化。
(5)①均属于原子晶体,原子半径越小,共价键的键长越短,键能越大,熔点越高;
②根据图知,每个B原子连接4个N原子;该晶胞中N原子个数是4、B原子个数=8×![]() +6×
+6×![]() =4,晶胞中所有原子体积=
=4,晶胞中所有原子体积=![]() π(
π(![]() )
)
×4×10-30cm3,ρ=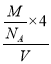 ,则V=
,则V=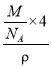 =
=![]() cm3,BN晶胞中原子的体积占晶胞体积的百分率=
cm3,BN晶胞中原子的体积占晶胞体积的百分率=![]() 。
。
![]() 的质子数是33,其基态原子的电子排布式为
的质子数是33,其基态原子的电子排布式为![]() ,有3个未成对电子;
,有3个未成对电子;
![]() 元素周期表中,与P紧邻的4种元素是N、Si、S、As,元素的非金属性越强,电负性越大,非金属性最大的是N元素,所以其电负性最大;元素的非金属性越强,第一电离能越大,P元素的原子核外3p亚层为半满,其第一电离能大于同周期相邻元素,所以Si、P、S三种元素的第一电离能由大到小的顺序是
元素周期表中,与P紧邻的4种元素是N、Si、S、As,元素的非金属性越强,电负性越大,非金属性最大的是N元素,所以其电负性最大;元素的非金属性越强,第一电离能越大,P元素的原子核外3p亚层为半满,其第一电离能大于同周期相邻元素,所以Si、P、S三种元素的第一电离能由大到小的顺序是![]() ;
;
![]() 铵盐大多不稳定,
铵盐大多不稳定,![]() F、
F、![]() 中,较易分解的是
中,较易分解的是![]() ,原因为 F原子半径比I原子小,
,原因为 F原子半径比I原子小,![]() 键比
键比![]() 键强
键强![]() 更易形成
更易形成![]() ,
,![]() 更易夺取
更易夺取![]() 中的
中的![]() ;
;
![]() 常温下,咖啡因在水中的溶解度较小,加适量水杨酸钠
常温下,咖啡因在水中的溶解度较小,加适量水杨酸钠![]() 后,因咖啡因与水杨酸钠形成了氢键,所以可使其溶解度增大,结合图示,N原子形成的化学键中有单键和双键,所以杂化类型有
后,因咖啡因与水杨酸钠形成了氢键,所以可使其溶解度增大,结合图示,N原子形成的化学键中有单键和双键,所以杂化类型有![]() 和
和![]() ;
;
![]() 它们熔点不同的原因为氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低;
它们熔点不同的原因为氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低;
![]() 由晶胞结构图知,B原子位于晶胞的顶点和面心,N原子位于晶胞内四个不相邻的小四面体的体心,所以晶体中一个B原子周围距离最近的N原子有4个;晶胞中有4个B原子和4个N原子,原子占的体积分别为:
由晶胞结构图知,B原子位于晶胞的顶点和面心,N原子位于晶胞内四个不相邻的小四面体的体心,所以晶体中一个B原子周围距离最近的N原子有4个;晶胞中有4个B原子和4个N原子,原子占的体积分别为:![]() 、
、![]() ,晶胞体积为:
,晶胞体积为:![]() ,BN晶胞中原子的体积占晶胞体积的百分率为
,BN晶胞中原子的体积占晶胞体积的百分率为![]() 。
。

【题目】重铬酸钾别名为红矾钾,室温下为橙红色晶体,溶于水,不溶于乙醇。它被国际癌症研究机构划归为第一类致癌物质,而且是强氧化剂,在实验室和工业中都有很广泛的应用。实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。相关资料如下:
序号 | 资料 |
① | Cr2(SO4)3溶液呈绿色 |
② | 酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2 |
③ | CrO5可溶于水,易溶于乙醚得到蓝色溶液 |
④ | 乙醚是一种无色不溶于水,密度比水小的有机溶剂,化学性质稳定 |
甲同学采用如图装置进行实验,探究了酸性条件下K2Cr2O7溶液和H2O2溶液的反应产物,实验步骤、操作等内容如下:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装仪器 | —— |
Ⅱ | ? | —— |
Ⅲ | 向盛有H2O2溶液的仪器X中加入一定量的K2Cr2O7溶液和硫酸 | 溶液立即变为紫红色,此时pH=1,观察到溶液中持续产生气泡,最终溶液变为绿色 |
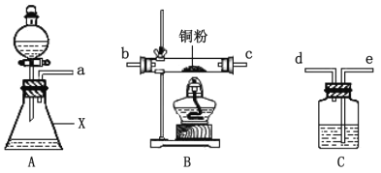
回答下列问题:
(1)用以上装置证明实验中产生的气体有氧气,装置的连接顺序是a→__→__→__→__。
(2)图中仪器X的名称是___。
(3)实验步骤Ⅱ是___。
(4)实验中紫红色溶液含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是___。
②已知CrO5的结构式为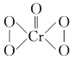 ,生CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
,生CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。你还能做出的假设②是___。
(6)设计实验,选择合适的试剂,验证(5)中的假设①,你的设计是___。