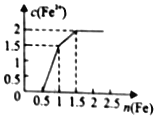
题目内容
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是( )
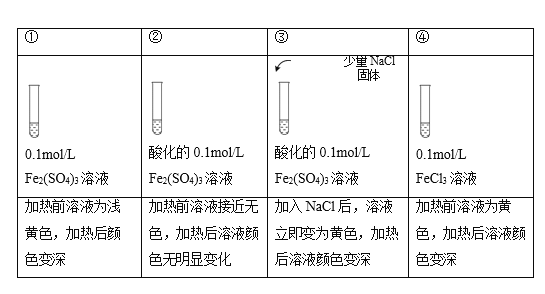
注:加热为微热,忽略体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④,可证明升高温度,Fe3+水解平衡正向移动
【答案】D
【解析】
A.加热促进水解,铁离子水解生成氢氧化铁,则实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3, A项正确;
B.由Fe3++3H2OFe(OH)3+3H+可知,酸化后加热溶液颜色无明显变化,氢离子抑制水解,则实验②中酸化对Fe3+水解的影响程度大于温度的影响,B项正确;
C.加入NaCl后,溶液立即变为黄色,发生Fe3++4Cl-+2H2O[FeCl4(H2O)2]-,[FeCl4(H2O)2]-为黄色,加热时平衡正向移动,溶液颜色变深,C项正确;
D.由实验③可知,④中存在Fe3++4Cl-+2H2O[FeCl4(H2O)2]-,升高温度平衡正向移动,溶液颜色变深,不能证明对Fe3+水解平衡的影响,D项错误;
答案选D。

【题目】根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是

选项 | 实验 | 实验现象 | 结论 |
A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr < Ag2S |
D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D