题目内容
【题目】一定温度下,向容积为2 L的密闭容器中充入一定量的气体A和气体B,发生反应: 2A(g)+B(g) ![]() 2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
反应时间/min | n(A)/mol | n(B)/mol |
0 | 0.10 | 0.060 |
t1 | 0.012 | |
t2 | 0.016 |
A.在0~t1 min内的平均反应速率为v(C)=![]() molL-1min-1
molL-1min-1
B.其他条件不变,起始时向容器中充入0.10 mol C和0.010 mol B,平衡时n(A)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(A)=0.0070 molL-1,则反应的ΔH<0
D.相同温度下,起始时向容器中充入0.15mol A和0.090mol B,平衡时A转化率小于88%
【答案】BC
【解析】
列出三段式,找出所需各量:
2A(g)+B(g) ![]() 2C(g)
2C(g)
起始量 0.10mol 0.06mol 0
变化量 0.088mol 0.044mol 0.088mol
t1时刻0.012mol 0.016mol 0.088mol,
由表格数据可知,t2时刻B的物质的量与t1时刻相同,说明t1时刻已达平衡,据此分析解答。
A. 在0~t1 min内的平均反应速率为v(C)=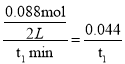 molL-1min-1,A错误;
molL-1min-1,A错误;
B. 其他条件不变,起始时向容器中充入0.10 mol C和0.010 mol B,将生成物全部转化为反应物,n(A)= 0.10mol,n(B)= 0.06mol,n(C)= 0,与原平衡等效,所以平衡时n(A)=0.012 mol,B正确;
C. 保持其他条件不变,升高温度,平衡时c(A)=0.0070 molL-1>0.0060 molL-1,说明平衡逆向移动,则反应的ΔH<0,C正确;
D. 相同温度下,起始时向容器中充入0.15mol A和0.090mol B,相当于原平衡体系加压,使压强变为原来的1.5倍,平衡正向移动,平衡时A转化率大于88%,D错误;
故选BC。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案