题目内容
已知H2A是一种无机二元酸,请回答以下问题:
(1) 若H2A为二元弱酸,在水溶液中的电离方程式为 ;
(2) 若NaHA溶液显碱性,则H2A是 (填“强酸”、“弱酸”或“无法确定”),原因是 。
(3) 若溶液显酸性,在25℃下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 ;
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=0.1 mol·L-1
c.c(Na+)>c(K+) d.c(Na+)=c(HA-)+c(A2-)
(1)H2A H++HA-,HA-
H++HA-,HA- H++A2-(2分)
H++A2-(2分)
(2)弱酸(1分)HA-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(2分)
(3)a(2分) ;
解析试题分析:(1)多元弱酸部分电离,分步书写。(2)若NaHA溶液显碱性, 说明HA-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(3)在25℃下,任何溶液一定存在c(H+)·c(OH-)=1×10-14,故a正确;滴加到溶液刚好反应时,生成Na2A和K2A,溶液呈碱性,要成中性必须NaHA过量,故b错、C错;根据物料守恒:c(Na+)=c(HA-)+c(A2-)+ c(H2A),故d错。
考点:考查弱电解质的电离、盐类水解、水溶液中的离子平衡等相关知识。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
表2
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
下表是不同温度下水的离子积的数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: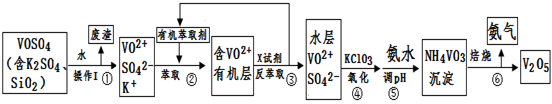
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
实验步骤如下:
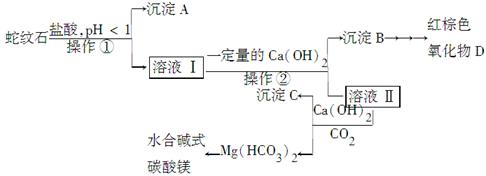
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3 C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
请回答有关滴定过程中的相关问题。
(1)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如图所示。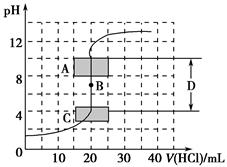
①在图中A的pH范围使用的指示剂是________;
C的pH范围使用的指示剂是________。
②下列关于上述中和滴定过程中的操作,正确的是________(填序号)。
| A.用碱式滴定管量取已知浓度的烧碱溶液 |
| B.滴定管和锥形瓶都必须用待装液润洗 |
| C.滴定过程中始终注视锥形瓶中溶液颜色变化 |
| D.锥形瓶中的待测液可用量筒量取 |
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。