题目内容
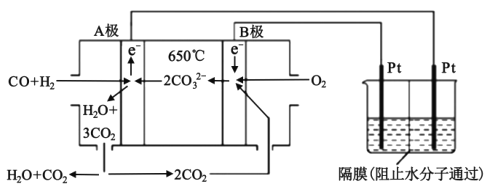
【题目】采用电化学方法以SO2和Na2SO3为原料制取硫酸的装置如图所示(A、B为多孔石墨电极,C、D为惰性电极)。下列说法错误的是( )

A.“膜2”为阳离子交换膜
B.电极A的电极反应为SO2-2e-+2H2O==SO42-+4H+
C.上述过程中,亚硫酸钠溶液可循环使用
D.使用该装置制取98g硫酸需消耗11.2L O2(STP)
【答案】D
【解析】
根据装置图,生成氢气的一极为阴极,所以电极D为阴极,得到电子,发生还原反应,其电极反应为:2HSO3-+2e-=2SO32-+H2↑,电极C为阳极,失去电子,发生氧化反应,其电极反应式为:HSO3--2e-+H2O =SO42-+3H+;电极A为负极,二氧化硫失去电子生成硫酸根离子,发生氧化反应,其电极反应式为:SO2-2e-+2H2O==SO42-+4H+;电极B为正极,氧气得到电子,发生还原反应,其电极反应式为:O2+4e-+4H+=2H2O。
A. 电极D为阴极,溶液中的阳离子移向阴极,所以“膜2”为阳离子交换膜,A正确;
B. 电极A为负极,二氧化硫失去电子生成硫酸根离子,发生氧化反应,其电极反应为:SO2-2e-+2H2O=SO42-+4H+,B正确;
C. 根据装置图,X为Na2SO3,与SO2反应,生成NaHSO3,NaHSO3到溶液中又生成Na2SO3,所以Na2SO3溶液可循环使用,C正确;
D. 左侧室的总反应为:2SO2+ O2+2H2O=2H2SO4,右侧室的总反应为3HSO3-+ H2O=2SO32-+H2↑+SO42-+3H+,制取98g硫酸,标准状况下消耗不了11.2L O2,D错误;故答案为:D。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
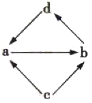
全程金卷系列答案【题目】下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 | a | b | c | d |
|
① | Na2O | Na2O2 | Na | NaOH | |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | MgO | MgCl2 | Mg | Mg(OH)2 |
A.①②④B.①③④C.①②③D.②③④