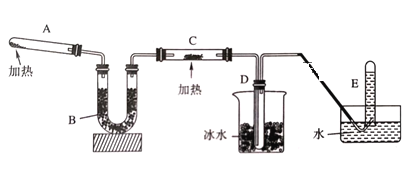
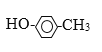
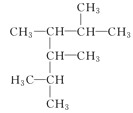
题目内容
【题目】某溶液中只可能含有Fe2+、A13+、NH4+、CO32-、AlO2-、SO32-、SO42-、C1-中的若干种(忽略水的电离),离子浓度均为0.2mol·L-1,现取该溶液加入稀硫酸后得强酸性X溶液,过程中无明显现象,取X溶液进行以下实验:
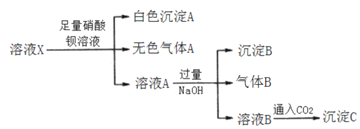
下列说法中正确的是( )
A. 无法确定沉淀C的成分
B. 无法确定原溶液中是否含有Cl-、A13+
C. 溶液A中存在的阳离子有Ba2+、Fe2+、NH4+、H+
D. 原溶液中存在Fe2+、NH4+、Cl-、SO42-
【答案】D
【解析】
加入的是稀硫酸,无明显现象,直接排除CO32-,AlO2-、SO32-,此过程中引入了SO42-,且溶液呈酸性溶液X,
①X溶液中滴加Ba(NO3)2溶液至过量会产生白色沉淀A,白色沉淀A为BaSO4,加入硫酸引入了SO42-,不能说明原溶液中含有SO42-.得到无色气体A,A遇空气变成棕色,A为NO,说明原溶液中含有还原性离子,故一定含有Fe2+,过滤,获得溶液A,溶液A中含有Fe3+、Ba2+等;
②在溶液A中加入过量的NaOH溶液产生气体、沉淀B,沉淀B为Fe(OH)3,产生气体,该气体一定为NH3,原溶液中含有NH4+,过滤,获得溶液B,溶液B含有Ba2+等;
③在溶液B中通入适量CO2气体有沉淀C产生,则沉淀为BaCO3或Al(OH)3或二者都有,
原溶液一定有Fe2+、NH4+,一定不含CO32-,AlO2-、SO32-,可能含有Al3+、SO42-、Cl-,由于离子浓度均为0.2mol·L-1,根据电荷守恒,阳离子总电荷一定大于等于0.6mol·L-1,但是阴离子总电荷最大只能为0.6mol·L-1,故一定存在SO42-、Cl-,一定不存在Al3+,
综合上述分析,可知原溶液一定有Fe2+、NH4+、SO42-、Cl-,一定不含Al3+、CO32-,AlO2-、SO32-。
A.由分析可知,原溶液中不含Al3+,故沉淀C为BaCO3,故A错误;
B.由分析可知,溶液中一定含有Cl-,一定不含Al3+,故B错误;
C.由分析可知,溶液A中Ba2+、Fe3+、NH4+、H+,故C错误;
D.由分析可知,原溶液一定有Fe2+、NH4+、SO42-、Cl-,故D正确;
故选:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案