题目内容
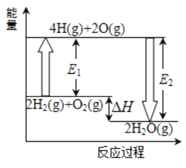
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是

A.反应中Fe+是催化剂,FeO+是中间产物
B.当有14g N2生成时,转移1mol e
C.升高温度,总反应的平衡常数K减小
D.总反应速率由反应②的速率决定
【答案】D
【解析】
A.反应①中Fe+参加了反应:Fe++N2O→FeO++N2,生成了FeO+;反应②中FeO+被消耗,又生成了Fe+:FeO++CO→Fe++CO2,所以反应中Fe+是催化剂,FeO+是中间产物,故A正确;
B.总反应为CO +N2O=CO2+N2,生成1mol N2,转移2mol e,所以生成14g N2(即0.5molN2)转移1mol e,故B正确;
C.该反应的反应物的总能量高于生成物的总能量,所以反应为放热反应,升高温度,平衡逆向移动,平衡常数K减小,故C正确;
D.从图中可以看出,反应①的活化能高于反应②的活化能,所以反应①的速率慢,总反应速率由反应①决定,故D错误;
故选D。

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目