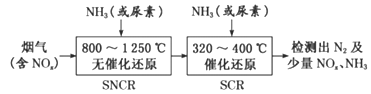
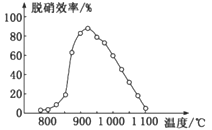
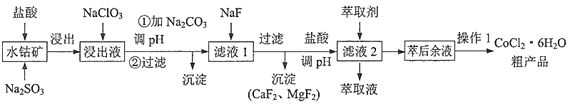
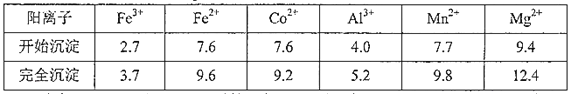
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
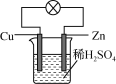
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
【答案】C
【解析】
A. 0.3mol·L-1A1(NO3)3溶液,但是并没有告诉溶液的体积是多少,故无法计算溶液中含的A13+数,故A错误;
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,该反应是可逆反应,若向某密闭容器中加入NA个氢分子和NA个碘分子,无法完全反应,则充分反应后放出的热量小于akJ,故B错误;
2HI(g) △H=-akJ·mol-1,该反应是可逆反应,若向某密闭容器中加入NA个氢分子和NA个碘分子,无法完全反应,则充分反应后放出的热量小于akJ,故B错误;
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,因为H2--2e-,当正极产生1.12LH2时,即0.05mol H2,则外电路中通过的电子数为0.1NA,故C正确;
D. C2H4和CO的摩尔质量均为28 g/mol,故28 g C2H4和CO的混合气体物质的量为1 mol,混合气体中含有碳原子的数目为在NA和2NA之间,但不一定是1.5NA,故D错误;
答案选C。

练习册系列答案
相关题目