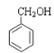
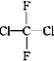
题目内容
【题目】甲同学利用下图所示装置在实验室制备乙酸乙酯
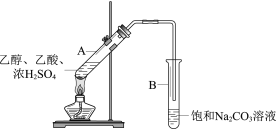
(1)实验中饱和Na2CO3溶液的作用是__________。
(2)分离出试管B中油状液体用到的主要仪器是_________________。
(3)乙醇和乙酸反应制乙酸乙酯是可逆反应。请根据化学平衡移动的相关知识写出一种增大乙酸乙酯产率的方法_________________。
(4)工业上用CH2=CH2和乙酸直接反应获得乙酸乙酯
①其反应类型是____。
②与实验室制法相比,工业制法的优点是_______________。
【答案】除去乙酸,吸收乙醇,降低乙酸乙酯的溶解度 分液漏斗 加大乙醇的量或者使生成物水的量减少 加成反应 副产物少,原子利用率高,环境友好
【解析】
(1)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:除去乙酸和乙醇,并降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离;
(2)乙酸乙酯不溶于饱和碳酸钠溶液,则混合液分层,可以通过分液操作将乙酸乙酯分离出来;
(3)依据勒夏特列原理分析;
(4)工业上用CH2=CH2和乙酸发生加成反应获得乙酸乙酯,没有副产物,原子利用率100%,据此分析解答。
(1)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质;
(2)乙酸乙酯不溶于饱和碳酸钠溶液,则混合液分层,可以通过分液操作将乙酸乙酯分离出来,故分离出试管B中油状液体用到的主要仪器是分液漏斗;
(3)由于乙醇和乙酸反应制乙酸乙酯是可逆反应,依据勒夏特列原理,提高乙酸乙酯的产率可以通过加大乙醇的量或者使生成物水的量减少;
(4)①根据反应物与生成物的结构可知,乙烯与乙酸发生加成反应可生成乙酸乙酯,反应类型是加成反应;
②因该反应为加成反应,生成物只有一种,没有副产物,与实验室制法相比,工业制法的优点是副产物少,原子利用率高,环境友好。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
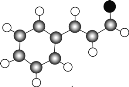
鹰派教辅衔接教材河北教育出版社系列答案【题目】乙二酸俗称草酸![]() 结构简式为
结构简式为![]() ,可简写为
,可简写为![]() ,它是一种重要的化工原料.
,它是一种重要的化工原料.![]() 常温下
常温下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 写出
写出![]() 的电离方程式______.
的电离方程式______.
![]() 溶液显酸性的原因是______;向
溶液显酸性的原因是______;向![]() 的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.![]()
![]()
![]()
![]()
![]() 与酸性高锰酸钾溶液反应,现象是有气泡
与酸性高锰酸钾溶液反应,现象是有气泡![]() 产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
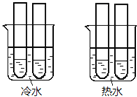
![]() 某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL
某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
![]() 已知草酸
已知草酸![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() ,写出
,写出![]() 在密闭容器中高温分解的化学方程式______.
在密闭容器中高温分解的化学方程式______.