题目内容
【题目】已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
【答案】C
【解析】
NaHSO3显酸性,HSO3-+H2O![]() H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3-![]() H++SO32-,HSO3-水解显碱性,电离显酸性,现NaHSO3溶液显酸性,说明HSO3-电离大于水解;而NaHCO3溶液显碱性,说明水解程度大于电离程度。
H++SO32-,HSO3-水解显碱性,电离显酸性,现NaHSO3溶液显酸性,说明HSO3-电离大于水解;而NaHCO3溶液显碱性,说明水解程度大于电离程度。
A、在NaHSO3溶液中,c(H+)>c(OH-),而在NaHCO3中,c(OH-)>c(H+),A不正确;
B、在溶液中,根据电荷守恒有,两溶液中,c(Na+)+c(H+)=c(HRO3-)+ 2c(RO32-)+c(OH-)B不正确;
C、在NaHSO3溶液中,电荷守恒,c(Na+)+c(H+)=c(HSO3-)+ 2c(SO32-)+c(OH-);物料守恒,c(Na+)=c(HSO3-)+ c(SO32-)+ c(H2SO3),联立两式,有c(H+)+c(H2SO3)=c(SO32-)+c(OH-),同理,NaHCO3溶液中也有该等式,C正确;
D、根据物料守恒,两溶液中均有c(Na+)=c(HRO3-)+(H2RO3)+c(RO32-),D不正确;
答案选C。

【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________。
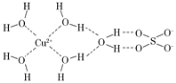
(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
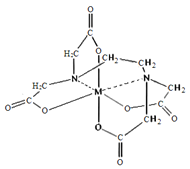
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_______,Fe3+的配位数为______。