��Ŀ����
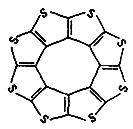
����Ŀ���Ҷ����׳Ʋ���![]() �ṹ��ʽΪ
�ṹ��ʽΪ![]() ���ɼ�дΪ
���ɼ�дΪ![]() ������һ����Ҫ�Ļ���ԭ�ϣ�
������һ����Ҫ�Ļ���ԭ�ϣ�![]() ������
������![]() ��
��![]() ��
��![]() ��
��![]() ��Һ��pH�����ʾ��
��Һ��pH�����ʾ��![]()
|
|
| |
pH |
|
|
|
��գ�
![]() �
д��![]() �ĵ��뷽��ʽ______��
�ĵ��뷽��ʽ______��
![]() ��Һ�����Ե�ԭ����______����
��Һ�����Ե�ԭ����______����![]() �IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����______��
�IJ��������Һ��μ�NaOH��Һ�����ԣ���ʱ��Һ�������Ũ�ȹ�ϵ��ȷ����______��
a.![]()
![]()
![]()
![]()
![]() �����Ը��������Һ��Ӧ��������������
�����Ը��������Һ��Ӧ��������������![]() ��������ɫ��ʧ��д����Ӧ�����ӷ���ʽ______����֪�÷�Ӧ��ʼʱ���ʽ����������ӿ죬���ܵ�ԭ����______��
��������ɫ��ʧ��д����Ӧ�����ӷ���ʽ______����֪�÷�Ӧ��ʼʱ���ʽ����������ӿ죬���ܵ�ԭ����______��
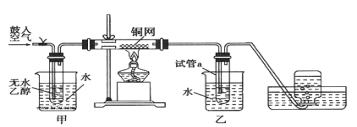
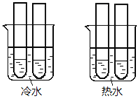
![]() ijͬѧ���ʵ����ͼ��ʾ�������ձ��е��Թܶ��ֱ�ʢ��2mL
ijͬѧ���ʵ����ͼ��ʾ�������ձ��е��Թܶ��ֱ�ʢ��2mL![]()
![]()
![]() ��Һ��4mL
��Һ��4mL![]() ����
����![]() ��Һ���ֱ��ϲ�����¼��Һ��ɫ����ʱ�䣮��ʵ��Ŀ�����о�______������ʵ��ʼ��û�п�����Һ��ɫ���Ʋ�ԭ��______��
��Һ���ֱ��ϲ�����¼��Һ��ɫ����ʱ�䣮��ʵ��Ŀ�����о�______������ʵ��ʼ��û�п�����Һ��ɫ���Ʋ�ԭ��______��
![]() ��֪����
��֪����![]() ���ȷֽ�Ļ�ѧ����ʽΪ��
���ȷֽ�Ļ�ѧ����ʽΪ��![]() ��д��
��д��![]() ���ܱ������и��·ֽ�Ļ�ѧ����ʽ______��
���ܱ������и��·ֽ�Ļ�ѧ����ʽ______��
���𰸡�![]() ��
��![]()
![]() �ĵ���̶ȴ���ˮ��̶� ad
�ĵ���̶ȴ���ˮ��̶� ad ![]() ��Ӧ���ɵ�
��Ӧ���ɵ�![]() �Ը÷�Ӧ���д����� �¶ȶԷ�Ӧ���ʵ�Ӱ��
�Ը÷�Ӧ���д����� �¶ȶԷ�Ӧ���ʵ�Ӱ�� ![]() ��Һ����
��Һ���� 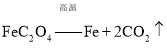
��������
![]() ������
������![]() ��
��![]() Ϊ
Ϊ![]() ��
��![]() ��pHΪ
��pHΪ![]() ��˵�������Ƕ�Ԫ���
��˵�������Ƕ�Ԫ���
![]() ���ܹ�����Ҳ�ܹ�ˮ�⣬
���ܹ�����Ҳ�ܹ�ˮ�⣬![]() ��Һ�����ԣ�˵��
��Һ�����ԣ�˵��![]() �ĵ���̶ȴ���ˮ��̶ȣ�
�ĵ���̶ȴ���ˮ��̶ȣ�
![]() ���������غ��жϣ�
���������غ��жϣ�
![]() ���ݵ���غ��жϣ�
���ݵ���غ��жϣ�
![]() ���������غ㡢����غ��жϣ�
���������غ㡢����غ��жϣ�
![]() ��ǡ�÷�Ӧ��
��ǡ�÷�Ӧ��![]() ����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ��
����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ��
![]() ������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�
������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�![]() �Ը÷�Ӧ���д����ã�
�Ը÷�Ӧ���д����ã�
![]() ���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���ݴ˷�����
���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���ݴ˷�����
![]() ��֪����
��֪����![]() ���ȷֽ�Ļ�ѧ����ʽΪ��
���ȷֽ�Ļ�ѧ����ʽΪ��![]() ������ֽ��ܹ�����CO��CO���л�ԭ�ԣ��ܹ���ԭFeO��
������ֽ��ܹ�����CO��CO���л�ԭ�ԣ��ܹ���ԭFeO��
![]() ��Ԫ����ֲ����룬������뷽��ʽΪ��
��Ԫ����ֲ����룬������뷽��ʽΪ��![]() ��
��![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��
![]() ���ܹ�����Ҳ�ܹ�ˮ�⣬
���ܹ�����Ҳ�ܹ�ˮ�⣬![]() ��Һ�����ԣ�˵��
��Һ�����ԣ�˵��![]() �ĵ���̶ȴ���ˮ��̶ȣ�
�ĵ���̶ȴ���ˮ��̶ȣ�
![]() ̼Ԫ������Һ�д�����ʽ�У�
̼Ԫ������Һ�д�����ʽ�У�![]() ��
��![]() ��
��![]() �����������غ���
�����������غ���![]() ����a��ȷ��
����a��ȷ��
![]() ���ݵ���غ��У�
���ݵ���غ��У�![]() ����Һ�����ԣ���
����Һ�����ԣ���![]() ����
����![]() ����b����
����b����
![]() ��
��![]() ��
��![]() ��֪��
��֪��![]() ����c����
����c����
![]() ��ǡ�÷�Ӧ��
��ǡ�÷�Ӧ��![]() ����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ����
����ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ����![]() ����d��ȷ��
����d��ȷ��
�ʴ�Ϊ��![]() �ĵ���̶ȴ���ˮ��̶ȣ�ad��
�ĵ���̶ȴ���ˮ��̶ȣ�ad��
![]() ������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��
������������Һ��Ӧ��������Һ�з���������ԭ��Ӧ�����ᱻ����Ϊ������̼��������ر���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��![]() ����Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�
����Ӧ��ʼʱ���ʽ����������ӿ죬˵�����ɵ�![]() �Ը÷�Ӧ���д����ã�
�Ը÷�Ӧ���д����ã�
�ʴ�Ϊ��![]() ����Ӧ���ɵ�
����Ӧ���ɵ�![]() �Ը÷�Ӧ���д����ã�
�Ը÷�Ӧ���д����ã�
![]() ���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���Թ��в��������������ʵ���֮��Ϊ1��2��������ع�����������ȫ��Ӧ�����Բ���ɫ��
���ձ���ˮ���¶Ȳ�ͬ����ʵ�����о��¶ȶԷ�Ӧ���ʵ�Ӱ�죻�����������ط�Ӧ�����ʵ���֮��Ϊ5��2���Թ��в��������������ʵ���֮��Ϊ1��2��������ع�����������ȫ��Ӧ�����Բ���ɫ��
�ʴ�Ϊ���¶ȶԷ�Ӧ���ʵ�Ӱ�죻![]() ��Һ������
��Һ������
![]() ��֪����
��֪����![]() ���ȷֽ�Ļ�ѧ����ʽΪ��
���ȷֽ�Ļ�ѧ����ʽΪ��![]() ��������������ȷֽ�Ļ�ѧ����ʽΪ
��������������ȷֽ�Ļ�ѧ����ʽΪ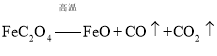 ��CO�ܹ���ԭFeO��
��CO�ܹ���ԭFeO��![]()
![]()
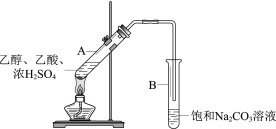
![]() �������䷴Ӧ����ʽΪ��
�������䷴Ӧ����ʽΪ��
![]() ��
��
�ʴ�Ϊ��
![]()

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�