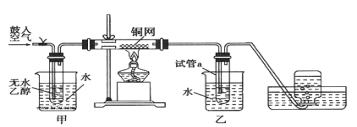
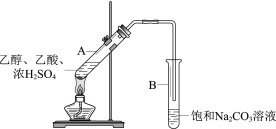
题目内容
【题目】碳是地球上组成生命的最基本的元素之一。按要求回答:
(1)碳原子核外有________种不同空间运动状态的电子,第一电离能介于B和C之间的元素的名称为_________。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是_______________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
③石墨与钾可形成石墨夹层离子晶体C8K(如图),其结构为每隔一层碳原子插入一层钾原子,与钾原子层相邻的上下两层碳原子排列方式相同,则与钾最近等距的配位碳原子有_________个。
(3)碳也可形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
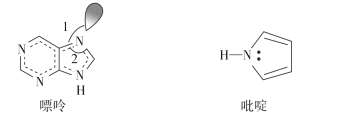
①1 mol 吡啶分子中含有σ键数目是__________。
②嘌呤结构中N原子的杂化方式为________。
③嘌呤中轨道之间的夹角∠1比∠2大,解释原因________________________________。
(4)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为ρ g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=________ pm (写出表达式即可)。

【答案】4 铍 平面三角形 氧化镁晶格能比氧化钙大,使得镁离子比钙离子更容易结合碳酸根中的氧离子 12 10NA sp2 孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大,键角大 ![]() ×1010
×1010
【解析】
(1)碳原子核外有6个电子,电子排布式为1s22s22p2,据此判断不同空间运动状态的电子数目;同周期主族元素随原子序数增大第一电离能呈增大趋势,ⅡA族、VA族第一电离能高于相邻元素,据此结合元素周期表分析解答;
(2)①CO32-中C的价层电子对数=3+![]() =3,据此分析判断;
=3,据此分析判断;
②根据金属阳离子结合氧离子的能力大小分析解答;
③根据石墨与钾可形成石墨夹层离子晶体C8K的结构图,2层碳原子中插入一层钾原子,与钾最近等距的碳原子有上下2层中对应的2个六边形,据此判断;
(3)①1个单键为1个σ键,1个双键为1个σ键和1个π键,根据吡啶(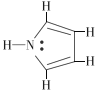 )的结构分析判断;
)的结构分析判断;
②嘌呤分子为平面结构,N形成3根共价键,根据杂化轨道理论分析判断;
③孤电子对与键合电子对之间的斥力>键合电子对与键合电子对之间的斥力,据此解答;
(4)根据图示计算一个T-碳晶胞中含有的碳原子数,从而计算1molT-碳晶胞的质量,结合T-碳的密度计算T-碳的晶胞参数a。
(1)碳原子核外有6个电子,电子排布式为1s22s22p2,其中2p上的3个原子轨道互相垂直,一共有4种不同空间运动状态的电子;同周期主族元素随原子序数增大第一电离能呈增大趋势,第ⅡA族、VA族满足全充满或半充满稳定状态,第一电离能高于同周期相邻元素的,第二周期中,第一电离能介于B元素和C元素间的元素是Be,名称为铍,故答案为:4;铍;
(2)①CO32-中C的价层电子对数=3+![]() =3,采用sp2杂化,立体构型为平面三角形,故答案为:平面三角形;
=3,采用sp2杂化,立体构型为平面三角形,故答案为:平面三角形;
②在离子晶体中,离子半径越小晶格能越大,所以在第ⅡA族金属碳酸盐中,阳离子半径越小对氧的吸引力越大,就越容易导致碳酸根的分解,所以在第ⅡA族中,随着原子序数的增加,原子半径增大,碳酸盐的分解温度也增大,所以MgCO3分解温度比CaCO3低,故答案为:氧化镁晶格能比氧化钙大,使得镁离子比钙离子更容易结合碳酸根中的氧离子;
③根据石墨与钾可形成石墨夹层离子晶体C8K的结构图,与钾最近等距的配位碳原子有上下2层中对应的2个六边形上的12个碳原子,故答案为:12;
(3)①1个单键为1个σ键,1个双键为1个σ键和1个π键,1 mol 吡啶( )分子中含有σ键数目是10NA,故答案为:10NA;
)分子中含有σ键数目是10NA,故答案为:10NA;
②嘌呤分子为平面结构,N形成3根共价键,根据杂化轨道理论,则N原子的杂化方式为sp2杂化,故答案为:sp2;
③根据VSEPR理论,孤电子对对键合电子对之间的斥力大于键合电子对对键合电子对之间的斥力,导致键合电子对与键合电子对之间的夹角减小,因此嘌呤中轨道之间的夹角∠1比∠2大,故答案为:孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大,键角大;
(4)一个金刚石晶胞中,含有C的数目为8×![]() +6×
+6×![]() +4=8,将每个C原子换成四面体结构的C,则T-碳晶胞中含有碳原子数目为8×4个,取1mol这样的晶胞,则有NA个这样的晶胞,则1molT-碳晶胞的质量为m=12×8×4g,T-碳密度为ρ g/ cm3,则1个晶胞的体积为
+4=8,将每个C原子换成四面体结构的C,则T-碳晶胞中含有碳原子数目为8×4个,取1mol这样的晶胞,则有NA个这样的晶胞,则1molT-碳晶胞的质量为m=12×8×4g,T-碳密度为ρ g/ cm3,则1个晶胞的体积为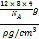 =
=![]() cm3,则T-碳的晶胞参数a=
cm3,则T-碳的晶胞参数a=![]() cm =
cm =![]() ×1010pm,故答案为:
×1010pm,故答案为:![]() ×10span>10。
×10span>10。

 轻松课堂单元期中期末专题冲刺100分系列答案
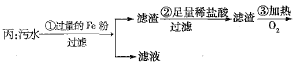
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
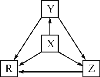
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D