题目内容
【题目】下列叙述不正确的是
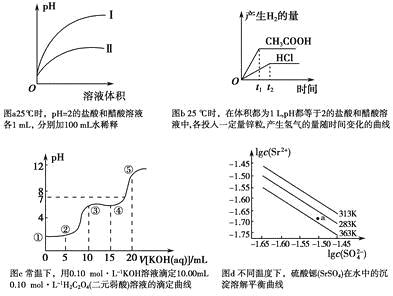
A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像
B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g
C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同
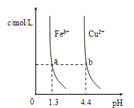
D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液
【答案】C
【解析】
A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中pH小于盐酸的pH,故Ⅱ应为醋酸稀释时的pH值变化曲线,故A正确;
B.1L、pH值等于2的盐酸溶液中c(H+)=0.01mol/L,n(H+)=0.01mol,1L、pH值等于2的醋酸溶液中存在电离平衡,平衡状态下氢离子浓度c(H+)=0.01mol/L,n(H+)=0.01mol,但溶液中醋酸的物质的量大于0.01mol;0.65g锌粒物质的量=![]() =0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快,故B正确;
=0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快,故B正确;
C.无论反应怎样,在①、②、③、④、⑤各点的溶液中都含有阴离子包括草酸根离子、草酸氢根离子、还有氢氧根离子,所以阴离子种类相同,故C错误;
D.由图象可知:在相同条件下,温度越低,c(SO42-)c(Sr2+)越大,Ksp(SrSO4)越大,a点在283K的下方,属于不饱和溶液,故D正确;
故选:C。