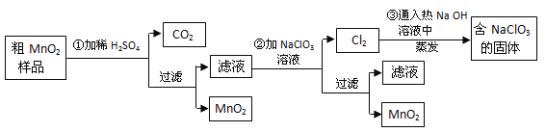
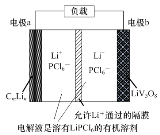
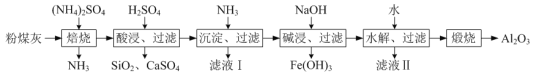
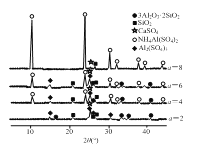
题目内容
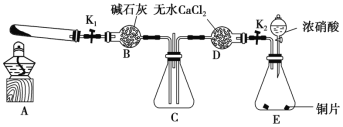
【题目】以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有___和___。
②通入空气的作用是___、___。
(4)“调节pH=3~4,并保温3个小时”的目的是___。
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

【答案】Cu2(OH)2SO4+2H+=2Cu2++SO42-+2H2O 取最后一次所得水洗液,向其中加入足量盐酸,再加入氯化钡溶液,若无沉淀生成,则铜片已洗涤干净 降低反应的温度 缓慢(分批次)滴入硝酸 将部分NO转化为NO2 将NO、NO2鼓入烧杯,使其能被NaOH溶液吸收 将溶液中的Fe3+充分水解转化为Fe(OH)3沉淀 向所得溶液中滴加硝酸,搅拌使其充分反应,同时鼓入空气并用NaOH溶液吸收所得混合气体,待溶液中无气泡产生,停止滴加,将溶液蒸发浓缩、冷却结晶、过滤、干燥得到NaNO3固体
【解析】
铜片用硝酸酸洗,洗去铜片表面难溶的Cu2(OH)2SO4,水洗去可溶性离子,再加硝酸进行酸溶,铜片溶解,得到大量的硝酸铜和杂质硝酸铁,调节pH=3~4,并保温3个小时,促进Fe3+水解,使Fe3+完全转化为Fe(OH)3沉淀,过滤得到硝酸铜的水溶液。
(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,“酸洗”时反应的离子方程式:Cu2(OH)2SO4+2H+=2Cu2++SO42-+2H2O;
(2)“水洗”去除铜片表面可溶性离子,“水洗”后检验铜片表面是否洗涤干净方法是:取最后一次所得水洗液,向其中加入足量盐酸,再加入氯化钡溶液,若无沉淀生成,则铜片已洗涤干净;
(3)①“酸溶”时为防止反应过于剧烈,减缓反应速率,可以采取的措施有适当降低反应温度、缓慢滴加硝酸溶液;
②通入氧气,可以把部分NO和NO2转化为硝酸,从而减少硝酸的用量,同时可以将装置内剩余的NO和NO2转移到烧杯内进行尾气吸收,故通入空气的作用是:部分NO和NO2转化为硝酸,从而减少硝酸的用量;将NO和NO2转移到烧杯内进行尾气吸收;
(4)调节pH=3~4,并保温3个小时,为了促进Fe3+水解,使Fe3+完全转化为Fe(OH)3沉淀;
(5)烧杯中所得溶液含有NaNO2和NaNO3,要完全转化为NaNO3,NaNO2需要加入硝酸进行转化,在此过程中有NO气体,防止该气体逸出,同时鼓入空气并用NaOH溶液吸收所得混合气体,待溶液中无气泡产生,停止滴加,将溶液蒸发浓缩、冷却结晶、过滤、干燥得到NaNO3固体。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入物质,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g) ΔH<0,测得反应的相关数据如下:
PCl5(g) ΔH<0,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
温度/℃ | 200 | 300 | 200 |
起始物质投入量 | 1molPCl3、2molCl2 | 2molPCl3、1molCl2 | 2molCl2、2molPCl5 |
平衡c(PCl5)/mol·L-1 | c1 | c2 | c3 |
化学平衡常数 | K1 | K2 | K3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(PCl3) | α2(Cl2) | α3(PCl5) |
下列说法正确的是( )
A.K1<K2
B.c1<c2
C.p3=2p1
D.α1(PCl3)+α3(PCl5)<1