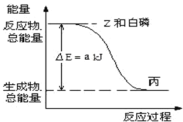
题目内容
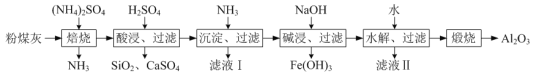
【题目】以粉煤灰(主要含3Al2O3·2SiO2、SiO2,还含有少量CaO、Fe2O3等物质)为原料制取Al2O3的流程如图:
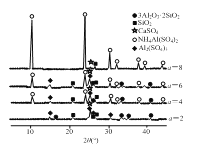
(1)当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
)不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
(2)“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3的离子反应方程式为___。
(3)“碱浸”加入NaOH发生反应的离子方程式为___。
(4)“水解、过滤”可得到Al(OH)3沉淀,升高温度有利于水解的原因是___。该步骤可将加水改成通入过量的___气体。
(5)流程中,可以回收并循坏利用的物质除NH3外,还有___和___。
【答案】8 Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+ OH-+Al(OH)3=AlO2-+2H2O 水解为吸热反应,升高温度有利于平衡正向进行 CO2 NaOH (NH4)2SO4
【解析】
粉煤灰、(NH4)2SO4进行灼烧处理,把3Al2O3·2SiO2转化为NH4Al (SO4)2,且当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同时各产物含量不同,如图a=8时,体系中NH4Al (SO4)2含量最高,此时3Al2O3·2SiO2的利用也率最高。加硫酸进行酸浸,过滤,滤液中含有Al3+、Fe3+以及其他可溶性离子,通入氨气生成沉淀Al(OH)3和Fe(OH)3,滤液Ⅰ为(NH4)2SO4,加入氢氧化钠进行碱浸取过滤,滤渣为Fe(OH)3滤液Ⅱ为NaOH 和NaAlO2,加水水解得到Al(OH)3沉淀,煅烧得氧化铝。
)不同时各产物含量不同,如图a=8时,体系中NH4Al (SO4)2含量最高,此时3Al2O3·2SiO2的利用也率最高。加硫酸进行酸浸,过滤,滤液中含有Al3+、Fe3+以及其他可溶性离子,通入氨气生成沉淀Al(OH)3和Fe(OH)3,滤液Ⅰ为(NH4)2SO4,加入氢氧化钠进行碱浸取过滤,滤渣为Fe(OH)3滤液Ⅱ为NaOH 和NaAlO2,加水水解得到Al(OH)3沉淀,煅烧得氧化铝。
(1)根据分析,当(NH4)2SO4和3Al2O3·2SiO2的配比a=8时,体系中NH4Al (SO4)2含量最高,此时3Al2O3·2SiO2的利用也率最高。
(2)通入氨气“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3离子反应方程式:Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+;
(3)根据分析,“碱浸”加入NaOH发生反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O;
(4)“水解、过滤”可得到Al(OH)3沉淀,水解过程是吸热的,升高温度促进AlO2-水解;该步骤可将加水改成通入过量的酸性气体二氧化碳(CO2+AlO2-+2H2O= HCO3- +Al(OH)3↓);
(5)流程中,滤液Ⅰ为(NH4)2SO4,滤液Ⅱ含有NaOH ,故可以回收并循坏利用的物质除NH3外,还有(NH4)2SO4和NaOH。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
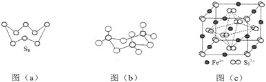
(1)基态S原子电子占据最高能级的电子云轮廓图为__________形。
(2)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__________形,其中共价键的类型有__________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(4)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
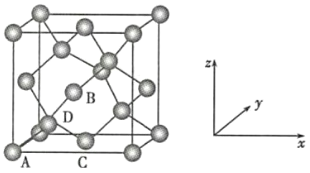
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g/cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为__________nm。
所形成的正八面体的体心,该正八面体的边长为__________nm。
晶胞有两个基本要素:
(6)晶胞的一个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__________。
,0)。则D原子的坐标参数为__________。