题目内容
以下说法正确的是( )
| A.不能自发进行的反应属于吸热反应 |
| B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应 |
| C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能 |
C
解析试题分析:A.不能自发进行的反应不一定属于吸热反应,错误;B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于吸热反应,错误;C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大,正确;D.催化剂通过改变反应路径,使反应速率增大,改变反应所需的活化能,错误。
考点:考查反应热与键能、温度、活化能等关系的知识。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
物质的熔沸点高低能用键能大小解释的是
| A.Na > K | B.O2> N2 | C.H2O > H2S | D.SiO2 > CO2 |
关于化学反应中的能量变化,下列说法中不正确的是( )
| A.燃烧反应都是放热反应 |
B.对于可逆反应:aA(g)+bB(g) bC(g)+dD(g),如果正反应放热,逆反应一定吸热 bC(g)+dD(g),如果正反应放热,逆反应一定吸热 |
| C.氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 |
| D.只有放热的氧化还原反应才可以设计为原电池 |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是 ( )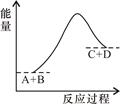
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
反应H2(g) +Br2(l) 2HBr(g)在25 ℃、101 kPa下进行, 已知生成2molHBr放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
2HBr(g)在25 ℃、101 kPa下进行, 已知生成2molHBr放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
| 1 mol分子中的化学键断时需要吸收能量/kJ | H2(g) | Br2(g) | HBr(g) |
| 436 | a | 369 |
A.404 B.260 C.230 D.200
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:
若在反应中消耗了1 mol乙烷(反应物),则有关该反应的说法正确的是( )
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知: 1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.+1220 kJ/mol | C.-1220 kJ/mol | D.+1780 kJ/mol |
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |