题目内容
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
D
解析试题分析:A、燃烧热是指1mol物质完全燃烧生成最稳定的化合物所放出的热量;氢气的燃烧热必须是1mol氢气燃烧生成液态水的过程所放出的热量,错误;B、已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,醋酸为弱电解质,反应过程中不断电离,醋酸的电离吸热,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ,错误;C、碳完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即a<b,错误;D、已知C(s,石墨)═C(s,金刚石)△H>0,石墨能量小于金刚石,则石墨比金刚石稳定,正确。
考点:考查燃烧热、中和热的概念,反应热的比较,物质稳定性的判断。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案以下说法正确的是( )
| A.不能自发进行的反应属于吸热反应 |
| B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应 |
| C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能 |
CO(g)+H2O(g)  H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
| A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
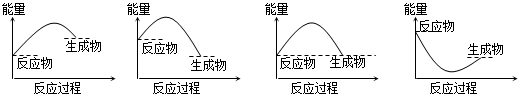
分析下图的能量变化示意图,下列选项正确的是
| A.2C====2A+B;ΔH>0 |
| B.2A+B====2C;ΔH>0 |
| C.2C(g)="===" 2A(g)+B(g);ΔH<0 |
| D.2A(g)+B(g)====2C(g);ΔH<0 |
下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定 |
| C.由2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为-571.6 kJ·mol-1 |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4  N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
| A.反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵只起氧化剂作用 |
已知下列热化学方程式:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
Fe2O3(s)+ 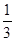 CO(g)
CO(g)
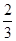 Fe3O4(s)+
Fe3O4(s)+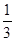 CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/mol
Fe3O4(s)+ CO(g) 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |