题目内容
反应H2(g) +Br2(l) 2HBr(g)在25 ℃、101 kPa下进行, 已知生成2molHBr放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
2HBr(g)在25 ℃、101 kPa下进行, 已知生成2molHBr放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
| 1 mol分子中的化学键断时需要吸收能量/kJ | H2(g) | Br2(g) | HBr(g) |
| 436 | a | 369 |
A.404 B.260 C.230 D.200
D
解析试题分析:根据键能与反应热的关系可知:436+30+a-369×2=-72,解得a=-200.因此断开1molBr2(g) 分子中的化学键断时需要吸收能量200kJ,故选项是D。[来源:Zx
考点:考查物质的存在状态、反应热与化学键的键能的关系的知识。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与 关系如下图所示),经测定其密度为
关系如下图所示),经测定其密度为 g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
A.该晶体结构与ZnS晶体相似
B.该晶体每个晶胞中有2个A2+和B2-
C.该晶体晶胞的边长为
 cm
cmD.A2+离子紧邻的B2-构成的空间结构为立方体
已知反应A+B=C+D的能量变化如右图所示,下列说法正确的是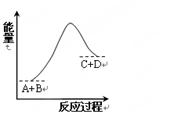
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
以下说法正确的是( )
| A.不能自发进行的反应属于吸热反应 |
| B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应 |
| C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能 |
下列有关热化学方程式的表示及说法正确的是( )
| A.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| B.已知I2(g)+H2(g)=2HI(g) △H1;I2(s)+H2(g)=2HI(g) △H2; 则△H1<△H2 |
| C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.已知H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量 |
下列关于能源和作为能源的物质的叙述错误的是
| A.吸热反应的反应物总能量低于生成物总能量 |
| B.绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D.天然气属于二次能源 |
下列属于吸热反应的是
| A.CaO + H2O = Ca(OH)2 | B.C + H2O CO + H2 CO + H2 |
| C.NaOH + HCl =" NaCl" + H2O | D.2Mg + CO2 2MgO + C 2MgO + C |
下列说法或表示方法中正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定 |
| C.由2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为-571.6 kJ·mol-1 |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
 kJ,破坏1mol氯气中的化学键消耗的能量为
kJ,破坏1mol氯气中的化学键消耗的能量为 kJ,形成1mol氯化氢中的化学键释放的能量为
kJ,形成1mol氯化氢中的化学键释放的能量为 kJ。下列关系式中正确的是( )
kJ。下列关系式中正确的是( )


