题目内容
16.等体积的盐酸和醋酸分别和等量的锌反应,已知反应开始时速率相等,反应结束后两种酸均有剩余,下列判断中不正确的是( )| A. | 反应前两种酸的物质的量浓度不同 | |
| B. | 反应开始后,盐酸的H+浓度减小快 | |
| C. | 反应开始后,醋酸的H+浓度减小快 | |
| D. | 从反应开始到结束,两种酸所用的时间相同 |
分析 醋酸是弱电解质,所以醋酸溶液中存在电离平衡,氯化氢是强电解质,完全电离,反应开始时速率相等,说明氢离子浓度相等,醋酸的浓度大于盐酸,据此分析.
解答 解:A、反应前醋酸浓度大于盐酸,两种酸的物质的量浓度不同,故A正确;
B、醋酸是弱电解质,所以醋酸溶液中存在电离平衡,氯化氢是强电解质,完全电离,所以反应开始后,盐酸的H+浓度减小快,故B正确;
C、醋酸是弱电解质,所以醋酸溶液中存在电离平衡,氯化氢是强电解质,完全电离,所以反应开始后,盐酸的H+浓度减小快,故C错误;
D、醋酸是弱电解质,所以醋酸溶液中存在电离平衡,氯化氢是强电解质,完全电离,反应开始时速率相等,说明氢离子浓度相等,反应过程中,醋酸能够继续电离,氢离子浓度始终比盐酸大,醋酸所用时间短,故D错误;
故选CD.
点评 本题考查了弱电解质的电离,明确等浓度的醋酸和盐酸中氢离子浓度相对大小及等pH的盐酸和醋酸中酸浓度大小的判断,为易错点.

练习册系列答案
相关题目
6.某溶液中含Na+、Ba2+、Ag+三种阳离子,该溶液中的阴离子可能是( )
| A. | NO3- | B. | SO42- | C. | CO32- | D. | Cl- |
7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
4.关于钠的叙述中,正确的是( )
| A. | 钠是银白色金属,密度很大 | |
| B. | 将金属钠放到水中不反应 | |
| C. | 金属钠在空气中燃烧,生成过氧化钠 | |
| D. | 金属钠的熔点很高 |
11.某金属的硝酸盐加热分解生成NO2和O2的分子数之比为4:1.在加热分解过程中,该金属元素( )
| A. | 化合价升高 | B. | 化合价降低 | C. | 化合价不变 | D. | 无法确定 |
20.甲烷、乙烯和苯是重要的有机物,下列关于它们化学性质的说法正确的是( )
| A. | 甲烷、乙烯都能使酸性KMnO4溶液褪色,苯不能 | |
| B. | 甲烷的特征反应是取代,乙烯是加成,而苯的结构特殊,只能取代不能加成 | |
| C. | 甲烷、乙烯、苯都能溶于溴的四氯化碳溶液且使它褪色 | |
| D. | 可用甲烷、乙烯燃烧时产生烟的大小区分甲烷和乙烯,苯燃烧时的烟比甲烷、乙烯都大 |
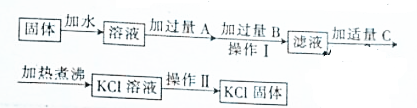
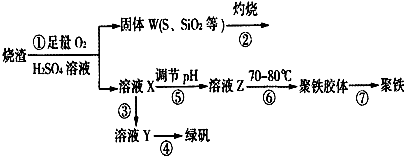
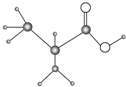 如图是只含有C、H、O、N四种元素的有机物的简易球棍模型,完成下列问题:
如图是只含有C、H、O、N四种元素的有机物的简易球棍模型,完成下列问题: .
.