题目内容
2.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),过程如图: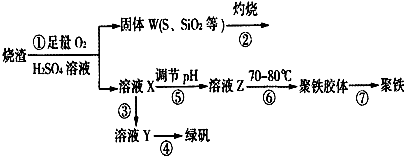
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是ACD;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)过程③中,需加入的物质是Fe(或铁);
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒;
(5)过程⑤调节pH可选用下列试剂中的C(填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是促进Fe3+的水解;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验.①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g.若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为28%.(假设杂质中不含铁元素和硫元素).
分析 烧渣中加入稀硫酸、同时通入氧气,过滤后,得到固体W中含有S、SiO2,再灼烧后尾气中含有二氧化硫.溶液X含有Fe2(SO4)3及未反应的硫酸,溶液X中加入Fe粉,反应完毕,过滤得到溶液Y为FeSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等得到绿矾.溶液X调节pH得到溶液Z,加热促进Fe3+的水解得到聚铁胶体,再经过胶体聚沉得到聚铁,通过调节pH可以控制氢氧化铁与硫酸铁的比例关系,
(1)过程②产生的气体为SO2,具有还原性和漂白性;
(2)根据反应物和生成物的种类结合质量守恒书写化学方程式;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成;
(6)过程⑤⑥目的为促进的水解,加热有利于水解的进行;
(7)根据n(Fe3+)=n(SO42-)计算.
解答 解:(1)过程②产生的气体为SO2,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性KMnO4溶液、溴水褪色,
故答案为:ACD;
(2)反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,
反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器,可能还需要泥三角,
故答案为:蒸发皿、玻璃棒;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成,
A.加入硫酸不能使溶液PH增大,故A错误;
B.加入碳酸钙生成微溶的硫酸钙,会引入新的杂质,故B错误;
C.加入NaOH可使溶液碱性增强,故C正确.
故答案为:C;
(6)过程⑤⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:促进Fe3+的水解;
(7)过滤、洗涤、干燥,称量,得固体质量为2.33g,应为BaSO4沉淀,
n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,
则n(Fe3+)=n(SO42-)=0.01mol,
m(Fe)=0.01mol×56g/mol=0.56g,
ω(Fe)=$\frac{0.56g}{2.0g}$=28%,
故答案为:28%.
点评 本题考查较为综合,涉及物质含量的测定、制备实验方案的设计等知识,题目难度较大,注意常见化学实验操作方法.

| A. | 食 盐 | B. | 食 醋 | C. | 白 糖 | D. | 瘦肉精 |
| A. | 常温常压下,2.3 g Na变成Na2O2时,失去0.2NA个电子 | |
| B. | 常温常压下,32 g氧气和32 g臭氧都含有2NA个氧原子 | |
| C. | 500 mL 0.2 mol/L NaOH溶液中含有NA个Na+离子 | |
| D. | 在20℃、1.01×105Pa时,11.2 L氮气含有NA个氮原子 |
| A. | 反应前两种酸的物质的量浓度不同 | |
| B. | 反应开始后,盐酸的H+浓度减小快 | |
| C. | 反应开始后,醋酸的H+浓度减小快 | |
| D. | 从反应开始到结束,两种酸所用的时间相同 |
| A. | H2O | B. | CH3COOH | C. | H2CO3 | D. | C2H5OH |
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
| A. | 淀粉 | B. | 油脂 | C. | 天然橡胶 | D. | 羊毛 |
| A. | 70%的酒精常用于医疗消毒 | |
| B. | 用食醋和澄清石灰水验证鸡蛋壳中含有碳酸盐 | |
| C. | 用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗下口放出 | |
| D. | 除去溴苯中的溴可以用氢氧化钠溶液 |